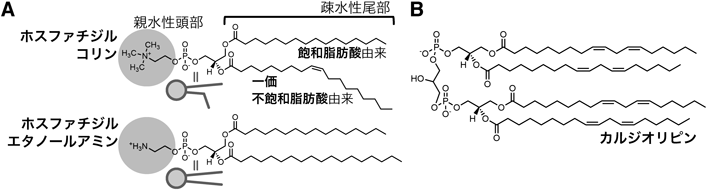
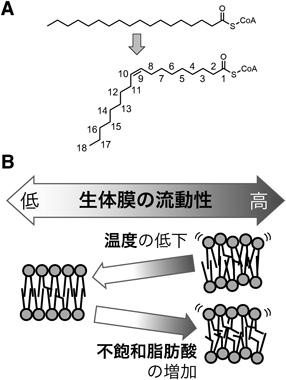
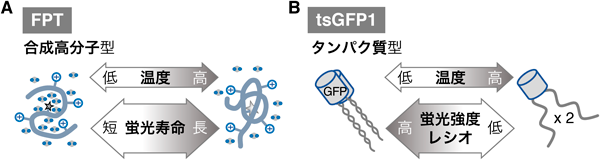
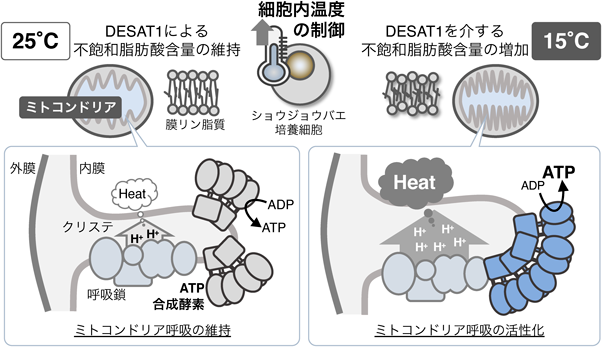
リン脂質の不飽和化を介した細胞自律的な細胞内温度制御機構Cell-autonomous control of intracellular temperature via unsaturation of phospholipid acyl chains
静岡県立大学薬学部School of Pharmaceutical Sciences, University of Shizuoka ◇ 〒422–8526 静岡県静岡市駿河区谷田52–1 ◇ 52–1 Yada, Suruga-ku, Shizuoka 422–8526, Japan