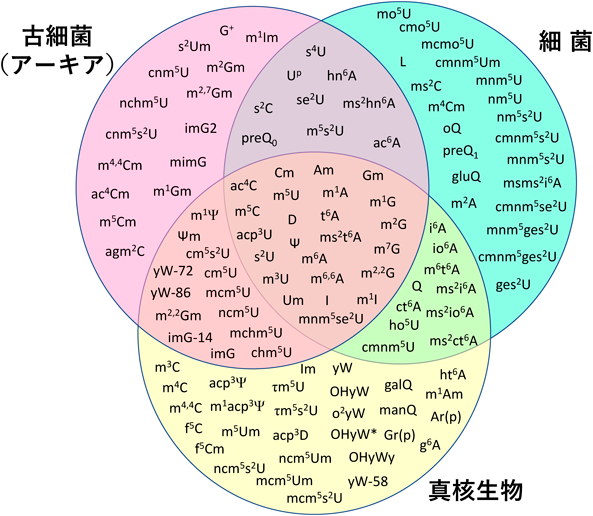
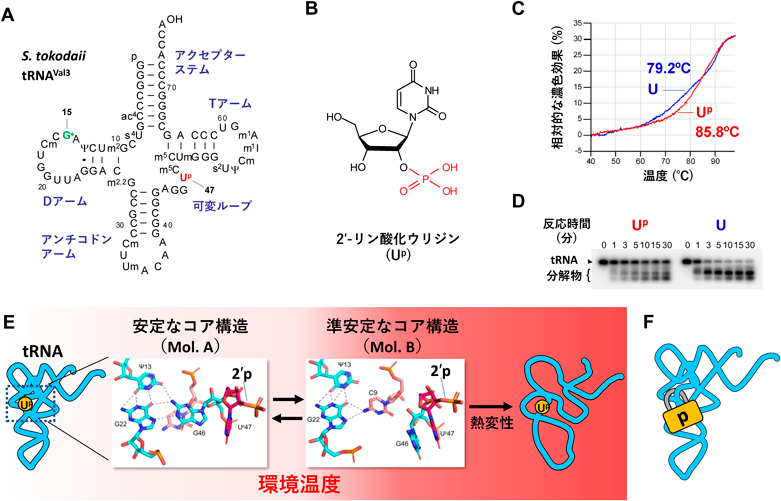
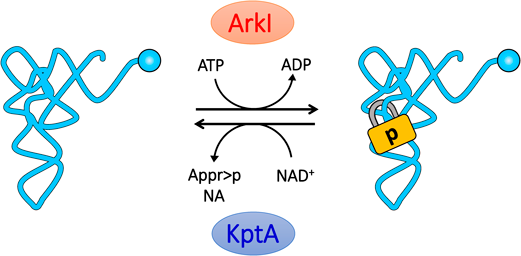
可逆的なRNAリン酸化修飾によるtRNAの構造安定化と生物の耐熱化Reversible RNA phosphorylation stabilizes tRNA and contributes to cellular thermotolerance
東京大学大学院工学系研究科化学生命工学専攻Chemistry and Biotechnology, Graduate School of Engineering, The University of Tokyo ◇ 〒113–8656 東京都文京区本郷7–3–1工学部3号館7階7A08 鈴木研究室 ◇ Suzuki Laboratory, Room 7A08 at 7th floor, Faculty of Engineering Building 3, The University of Tokyo, 7–3–1 Hongo, Bunkyo-ku, Tokyo 113–8656, Japan