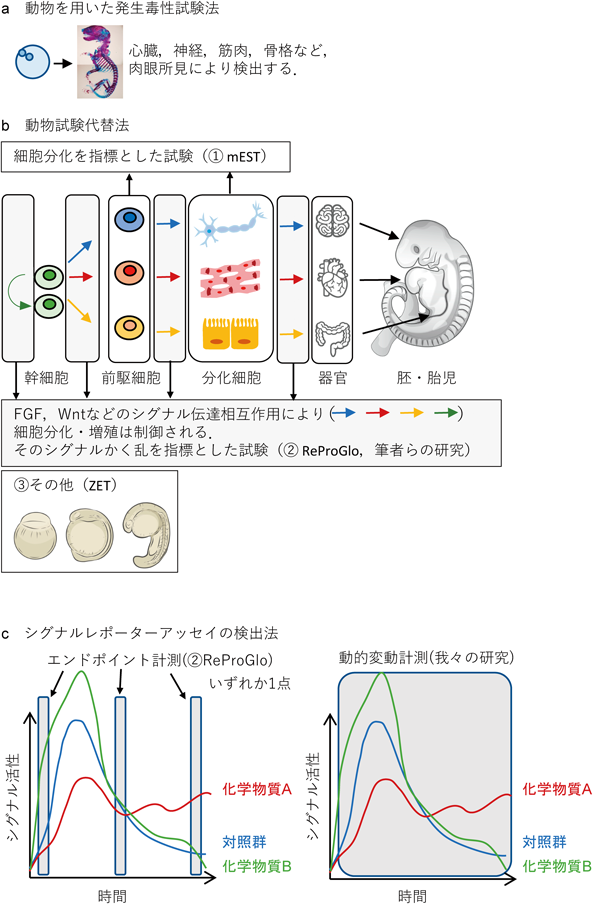
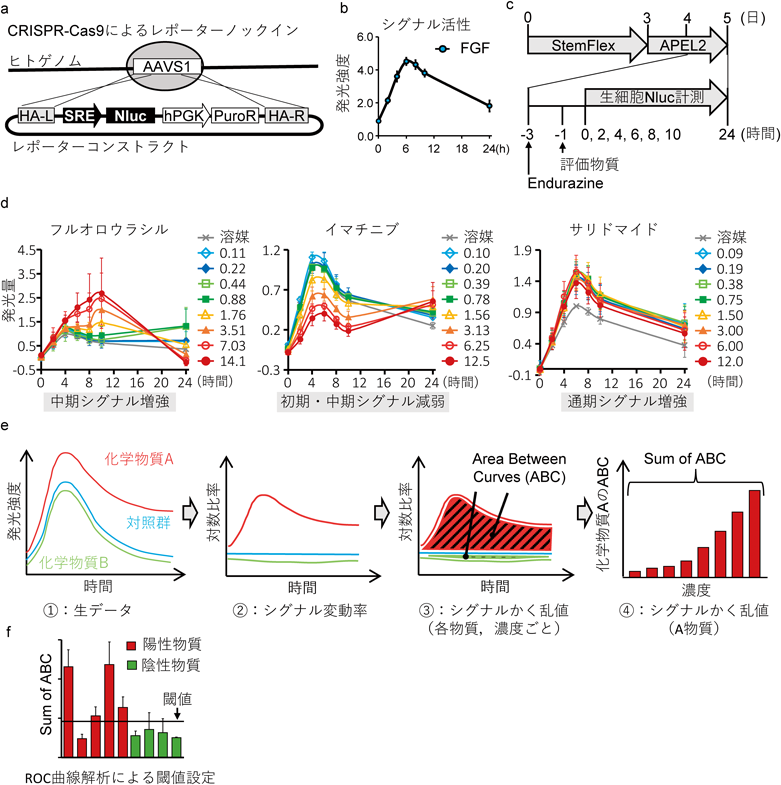
生細胞ルシフェラーゼアッセイを用いたFGFシグナルかく乱作用解析による発生毒性評価Evaluation of developmental toxicity analyzing by dynamics of signal disruption
1 国立医薬品食品衛生研究所安全性生物試験研究センター毒性部Division of Cellular and Molecular Toxicology, Biological Safety Research Center, National Institute of Health Sciences ◇ 〒210–9501 神奈川県川崎市川崎区殿町3–25–26 ◇ 3–25–26 Kawasaki-ku Tonomachi, Kawasaki, Kanagawa 210–9501, Japan
2 横浜国立大学大学院工学研究院機能の創生部門Faculty of Engineering, Yokohama National University ◇ 〒240–8501 神奈川県横浜市保土ヶ谷区常盤台79–5 ◇ 79–5 Tokiwadai, Hodogaya-ku, Yokohama, Kanagawa 240–8501, Japan