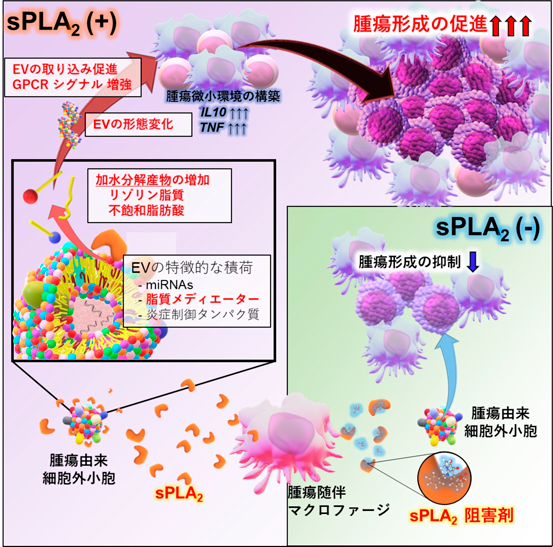
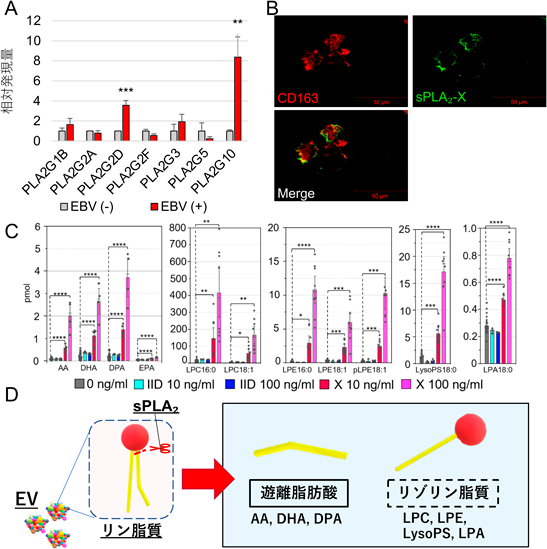
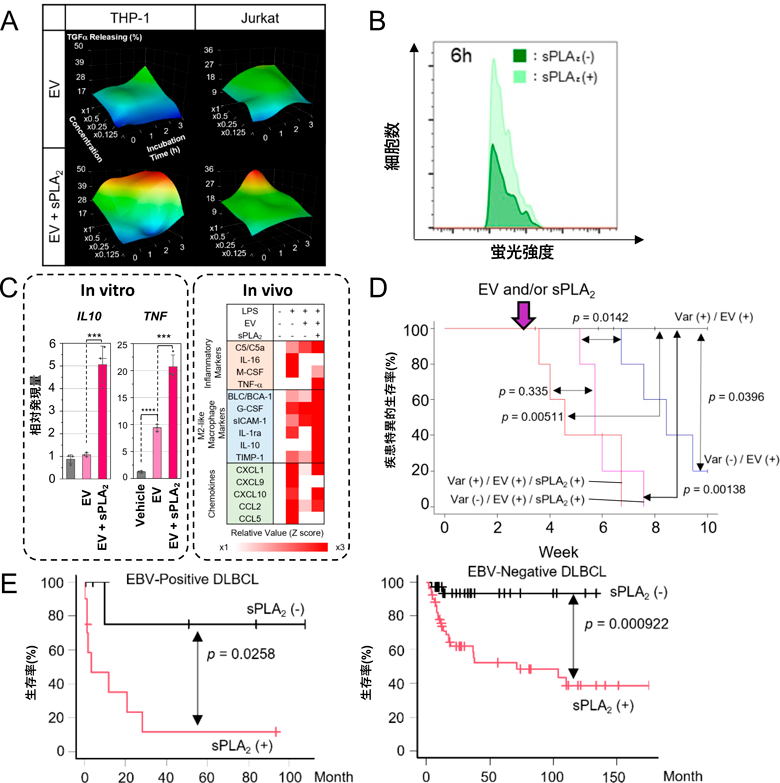
リンパ腫の発生/悪性化における細胞外小胞の新規作動メカニズム—鍵因子としてのsPLA2Lipid-orchestrated acceleration of malignant lymphoma via the secreted phospholipase A2-mediated modification of extracellular vesicles
東海大学医学部基盤診療学系先端医療科学Department of Innovative Medical Science, Tokai University School of Medicine ◇ 〒259–1193 神奈川県伊勢原市下糟屋143 ◇ Shimokasuya 143, Isehara, Kanagawa 259–1193, Japan