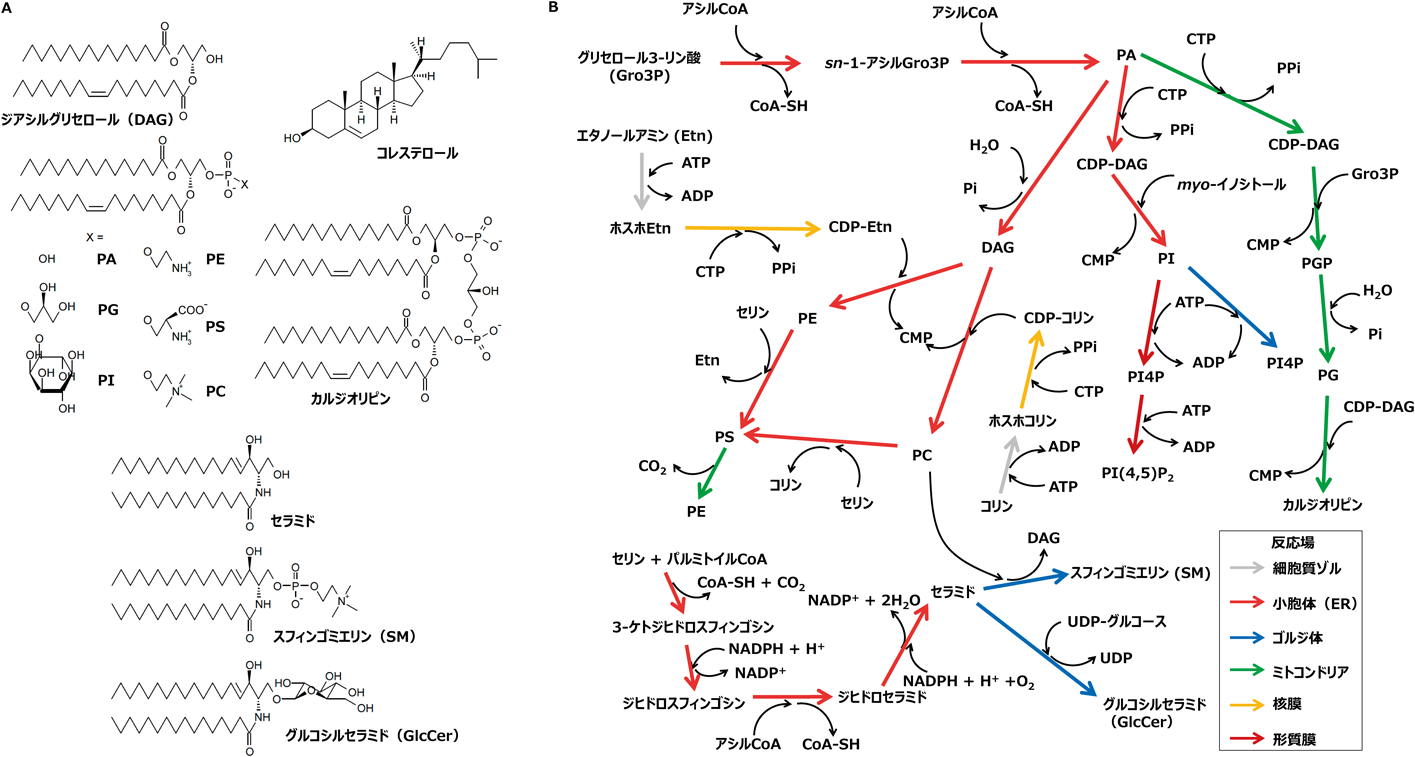
3. 現在のオルガネラ間脂質輸送モデルに至る歴史的背景
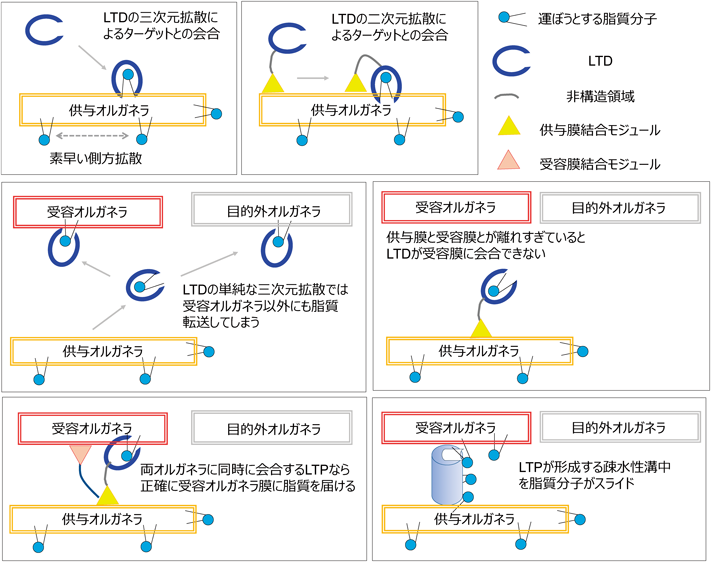
LTPsがオルガネラ膜接触部位(membrane contact sites:MCSs)と呼ばれる特殊な細胞内ゾーンにおいて効率のよい脂質転送を仲介しているという考え方は,今でこそ広く受け入れられるようになってきたものの,そこに至るまでは紆余曲折があった.
真核細胞において,ERで合成された分泌タンパク質や膜タンパク質が,輸送小胞と呼ばれる膜構造体に載せられて細胞表面まで運ばれていることは20世紀後半までに明らかになっていた7, 8).その類推から,ERで合成された脂質のオルガネラ間輸送にも輸送小胞が中心的な役割を果たすと当時は予想されていたのであるが,さまざまな実験事実はこの予想を支持しなかった.たとえば,ERから形質膜へのタンパク質の輸送を阻害する薬理学的手段や低温条件でも,新合成されたPCやコレステロールの形質膜への移動は阻害されない9, 10).有糸分裂期にはERからゴルジ体への小胞輸送経路が停止するにもかかわらず,新合成されたセラミドは複合スフィンゴ脂質に変換される11).このような経緯で,オルガネラ間の脂質選別輸送は分泌タンパク質の使う小胞輸送経路とは異なるようだと考えられるようになった.
MCSsは異なるオルガネラが(単一のタンパク質の大きさと同等のスケールである)10~30 nm程度の近距離にある細胞内亜領域であり,細胞中で最も広い膜表面を持つオルガネラであるERはおそらく他のすべての種類のオルガネラとの間で接触領域を有している12, 13).ERがミトコンドリアなどの他のオルガネラと接近しているようすは,古典的な電子顕微鏡観察でも認識されており14),その後,クライオ電子顕微鏡画像の三次元再構成解析によって,より詳細な接触ゾーンの画像が得られるようになった15).
また,カナダのVanceは,ミトコンドリアとの間でMCSsをなすERの亜領域を遠心法にて分離し,この分離画分をミトコンドリア会合膜(mitochondria-associated membrane:MAM)と命名して,MCSsを生化学的に解析する道を開いた16).しかし,MCSsがオルガネラ間脂質輸送に関与していることを示す有力な証拠は得られずにいた.なお,MAMは概念的にER膜の亜領域であってMCSsそのものではない.ER–ミトコンドリアMCSsは,「MAMとそれに相対するミトコンドリア外膜領域,および,これら膜領域に挟まれた細胞質ゾル部分を含む細胞内亜領域」とでも規定されるべきものであり,それは他のオルガネラMCSsも同様である.
LTPsは,その語自体に象徴されるように,膜間の脂質転送を触媒するタンパク質と定義される.LTPsの生化学的研究は,1960年代後半にオランダのWirtzらによって行われたin vitroアッセイ系での解析を嚆矢として広まったが17),LTPsがオルガネラ間の脂質輸送に重要な役割を果たすことがなかなか証明できなかった.この原因を現在の目で振り返ると,精製タンパク質の性状解析を基盤にしていた初期LTP研究は量的に豊富なLTPsに焦点を当てていたため,その生理的機能が脂質の膜間転送ではなく細胞質ゾルに大量にある両親媒性低分子の保持安定化であったこと,もしくは,機能的冗長性のせいで一つの遺伝子を欠損させても脂質代謝に有意な影響を及ぼさなかったことに起因すると思われる.
一方,ステロイド産生急性調節タンパク質(steroidogenic acute regulatory protein:StAR)をコードするヒト遺伝子の変異が,ある種の遺伝性のステロイドホルモン生産障害の原因変異であることが明らかにされ18, 19),次いで,StARがステロール転送を触媒することも生化学的手法で示されたことで20),in vitroで観察される脂質転送活性が生体内の脂質移動機能と関連するという考え方は命脈を保たれていた(ただし,StARは,ER–ミトコンドリア間輸送ではなく,ミトコンドリア外膜をステロールが通過する際に通る多成分複合体のサブユニットとして機能していると考えられている21)).
また,米国のPaganoらにより1980年代に開発された脂質の蛍光アナログも脂質の細胞内輸送の研究を促進する重要なツールとして汎用されてきたのであるが22),天然脂質の細胞内移動を本当に反映しているツールなのかという懐疑論がぬぐえずにいた.
このような時代背景の元,筆者らは,セラミドのSMへの変換や蛍光性セラミドのERからゴルジ体への移行が不全となっている哺乳動物細胞変異株を分離することに成功し23, 24),この変異株を用いた体細胞遺伝学的アプローチによって,セラミドのオルガネラ間輸送を媒介する分子実体であるCERTを2000年代になって同定した25).LTPsの一つであるCERTは,セラミドの膜間転送を触媒するだけでなく,ER–ゴルジ体のMCSsで作用する生化学的・構造的特徴を持ち,本LTPがオルガネラのMCSsで脂質転送を効率的に行っているというモデルを世界に先駆けて提唱した26).
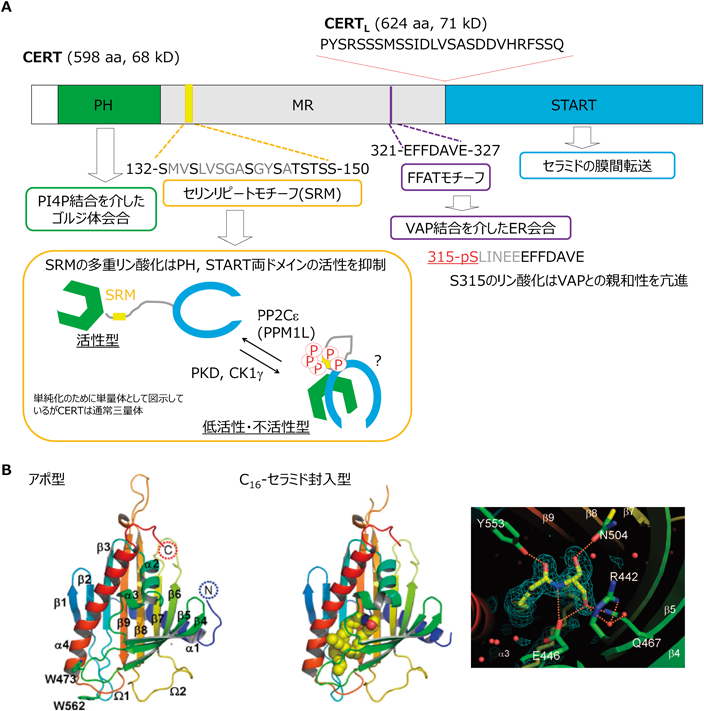
1)ゴルジ体と会合するためのプレクストリン相同(pleckstrin homology:PH)ドメイン
CERTのN末端の約100アミノ酸からなる領域はPHドメインを形成している(図2A).CERTのPHドメインは,さまざまなホスホイノシチドの中でもPI 4-モノリン酸(PI4P)に優先的に結合する25, 27–29).PI4Pは主に形質膜,ゴルジ体,トランスゴルジネットワーク(TGN),エンドソームに分布し,PI 4,5-ビスリン酸[PI(4,5)P2]の合成前駆体としてのみならず,それ自体がオルガネラを識別する因子の一つとして機能している30, 31).
PIをPI4Pに変換する酵素PI 4-キナーゼ(PI4K)にはさまざまなアイソフォームがあり,形質膜および核内はPI4KタイプIIIα(PI4KA),ゴルジ体はPI4KタイプIIIβ(PI4KB),エンドソームはPI4KタイプIIα(PI4K2A),というようにオルガネラごとに主要なPI4Kアイソフォームが異なる30, 32).
CERT PHドメインにおいては,ホスホイノシチド結合ポケットとPI4Pとの間の静電相互作用だけでなく,当該ポケット周辺にある塩基性の領域とPSのような酸性脂質との弱い相互作用が相加的に働くことでPI4P含有膜への高い親和性を生み出している28, 29).
なお,CERTは主にホモ三量体として存在しており33, 34),精製した単量体PHドメインを使って決定した結合定数に比べて三量体CERTのPI4Pへの親和性が格段に高いと推定される.同様の多量体効果は後述するER会合の親和性評価についてもいえる.
SMとグルコシルセラミド(GlcCer)はともにセラミドから合成されるが,CERT欠損細胞を用いた解析から,SM合成はCERTに依存するがGlcCer合成は依存しないことがわかった25, 35).そして,SM合成酵素は遠位ゴルジ体領域に多く分布し,一方,GlcCer合成酵素は近位ゴルジ体領域に多く分布する.C10orf76はPI4KB結合活性を有すること以外は機能未知のタンパク質である.最近,C10orf76はPI4KBを遠位ゴルジ体にリクルートさせること,そして,その結果として生産されるPI4PにCERTが会合することでERとSM合成酵素の局在する遠位ゴルジ体との間でCERTが特異的に働くことが見いだされた36).
2)セラミドの膜間移動のためのSTARTドメイン
CERTのC末端側の210アミノ酸からなる領域は,膜間の脂質転送を触媒する脂質転送ドメイン(lipid transfer domains:LTDs)の一つであり,StAR関連脂質転送(StAR-related lipid transfer:START)ドメインを形成している(図2A).ヒトゲノムには15種類のSTARTドメインがコードされていて,その多くはコレステロールもしくはPCを転送する37).STARD11とも呼ばれるCERTのSTARTドメインは,セラミドもしくはその構造類似体[ジヒドロセラミド,フィトセラミドといったセラミド類に加えて化学構造がセラミドに似ているジアシルグリセロール(DAG)]を転送し,セラミドのアシル鎖長についてもかなり広い範囲の分子種を認識できるが,SM, PC,コレステロールなどは運べない25, 38).
タンパク質を特定のオルガネラに動員するためのモジュールとして働くPHドメインなどの脂質結合ドメインは,主に脂質の極性部位との間の静電相互作用によって膜脂質と結合することができるが,膜から脂質分子を抽出することはできない.一方,STARTドメインのようなLTDsは,その両親媒性ポケット内に脂質の疎水性部位を保持することで,膜から脂質分子を抽出することができる.この二つの異なる「脂質結合」様式を区別するために,以下,LTDsによる脂質結合の仕方を「封入」と呼ぶことにする.
CERT STARTドメインとセラミドとの共結晶解析から以下のことがわかってきた(図2B)39).
- ①両親媒性のポケットに1分子のセラミドが埋まり,セラミド分子の水酸基とアミド基がポケット中の特定のアミノ酸残基と水素結合ネットワークを形成している.
- ②封入されたセラミド分子のC1位水酸基の周囲には限られたスペースしかないため,その位置にかさ高い基を持つSMやスフィンゴ糖脂質などは収容できない.
- ③基質になる脂質分子の認識にはポケットの内側表面を構成するアミノ酸残基とセラミドの炭化水素鎖との間のvan der Waals相互作用も重要であり,異なるタイプの炭化水素鎖との相互作用には異なるアミノ酸残基のセットが関与しうる.
これらの構造特性によって,本ドメインはセラミド特異性とセラミド類似分子種への柔軟性を併せて持つことが可能となっている.
3)ERと会合するためのFFATモチーフ
CERTのPHドメインとSTARTドメインの間の中間領域(アミノ酸残基118~370;以下MRと略記)の大部分は非構造状態にある40).MRには,ER膜タンパク質であるVAPs(VAP-AとVAP-Bの二つのアイソフォームがある)と結合する“two phenylalanines(FF) in an acidic tract”(FFAT)モチーフが存在し(図2A)41, 42),CERTは本モチーフ依存的にVAP-AおよびVAP-Bと会合することも示されている26).
CERTのPHドメインとFFATモチーフがそれぞれゴルジ体とERに結合しうるため,STARTドメインに封入されたセラミド分子は,CERT自体の細胞質ゾル中拡散を伴わずに「首振り」のような動きによって,ゴルジ体に届けられると考えられるようになった(図4A参照)26).
4)CERTのスプライシングバリアント
ヒトゲノム中においてCERTをコードする遺伝子(CERT1が現在の正式な遺伝子シンボルであるがCOL4A3BP/GPBP/STARD11/CERTと表記される場合もある)はユニークであり,パラログは存在しない.ただし,CERTのスプライシングバリアントとして,26アミノ酸をコードするエキソン部分がSTARTドメインの直前に挿入されたCERTL[グッドパスチャー抗原結合タンパク質(Goodpasture antigen-binding protein:GPBP)とも呼ばれる]が存在する(図2A).
CERTの方がCERTLよりも多くの種類の細胞で発現し,発現量も多い43).そして,両者ともにER–ゴルジ体間セラミド転送を仲介できる25, 44).興味深いことに,CERTL/GPBPはおそらく細胞外小胞分泌経路に乗って細胞外に放出されうるが45, 46),細胞外CERTLの生理的役割は未解明である.
5)生物の系統進化からみたCERTとSM合成酵素の分布
CERTのオーソログは多細胞動物である後生動物にしか見つかっていない40, 47).しかし,CERTが持つ機能モジュールであるPHドメインやFFATモチーフ,そして,それらに会合するPI4PやVAPは真核生物に広く存在する.明確なSTARTドメインのメンバーは後生動物にしか見つかっていないが,STARTドメインに類似した三次元的構造を持つLTD(StARkin, VAStもしくはAsterと呼ばれる)のメンバーは真核生物に広く分布する48).また,セラミド合成酵素は真核生物に広く存在する一方で,ヒトSM合成酵素の明確なホモログは後生動物にしか見つかっていない49).このように,CERTとSM合成酵素は生物の系統進化上での出現時期が似ている.
想像でしかないが,後生動物となる際に新たにSMという脂質種が必要となり,その際に,SMを合成する酵素に加えて,ERで合成されるセラミドをSM合成酵素の局在する領域に運ぶ装置を既存の機能モジュールを組み合わせながら生み出していったのかもしれない40).
濃度とは溶媒に単分子分散して溶けている特定の溶質の割合を指す用語であるが,本稿では,二次元的な膜に共存する特定の脂質と別の種類の脂質との割合を当該脂質の濃度と便宜上呼ぶことにする.
LTPsの有する脂質転送活性はそのLTDsに帰属される.LTDsは,高エネルギー結合加水分解と共役できる構造を自身の中に持っておらず,そのことは全長のLTPsでみてもごく一部の例外を除いて同様である.LTPsが触媒する過程自体は平衡反応であり,基質である脂質の濃度差(もしくは化学ポテンシャル差)が膜間でなくなる状態に向かって膜間移動を促す.しかし,生きている細胞の中では,新たに合成されたさまざまな種類の脂質がしばしば決まった方向に,場合によっては濃度差に逆らって,移動しているようにみえる.本章では,いくつかの例をあげて,オルガネラで起こる特異的な代謝反応や膜小胞輸送とLTPsを介した脂質のオルガネラ間転送の方向との関係を考察する.
1)CERTによるERからゴルジ体もしくはエンドソームへのセラミド転送
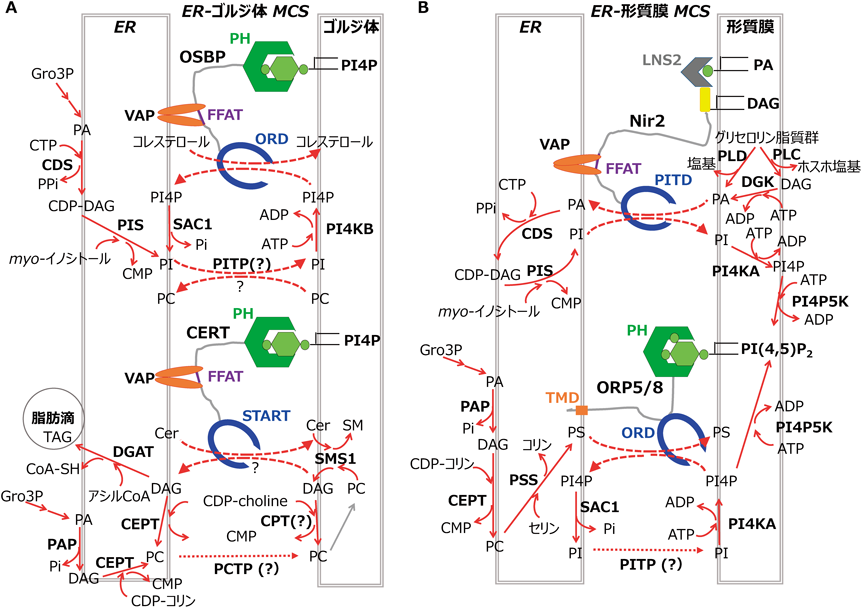
セラミドはERで新合成された後でCERTを介してゴルジ体に到達するとSM合成酵素の触媒する反応「セラミド+PC → SM+DAG」によってSMへと変換されて消費される(図4A).このように,特定の脂質クラスの代謝酵素が異なるオルガネラに局在する場合,オルガネラ間で当該脂質濃度の差が常時生まれるので,CERT自体はセラミドを低濃度の方向に転送するにすぎないとしてもERからゴルジ体への一方向性のセラミドの流れが熱力学的に矛盾なく生じうる.
SM合成反応ではSMとともにDAGが共生産される(図4A).DAGはSM合成酵素の阻害剤として働くので52),SMの合成部位にDAGが蓄積するのを防いでSM合成を継続していると想像されるが,その機序は不明である.可能性の一つとして,CERTがDAGをゴルジ体からERに逆転送し25, 38, 39),ERに運ばれたDAGはER局在のコリン/エタノールアミンリン酸転移酵素の反応「CDP-コリン/CDP-エタノールアミン+DAG → PC/PE+CMP」によってPC再生に利用されるのかもしれない(図4A).ERで合成されたPCがゴルジ体に至る分子機序もまだわかっていない.
SM合成酵素の触媒部位はゴルジ体の内腔側に向いているため53),セラミドとDAGがCERTとSM合成酵素の間を移動するにはゴルジ体膜を横断しなければならないはずであるが,そのための特別な分子装置は同定されておらず,電荷を持たないセラミドやDAGの場合は自発的な膜横断が起こるので膜横断のための装置は不要とも示唆されている54–56).
2)CERTによるERからエンドソームへのセラミド転送
エンドソーム成熟過程において膜が内腔側に落ち込んで複数の内腔小胞を有する多重小胞エンドソーム(multivesicular endosomes:MVEs)が形成され,その後,MVEsはリソソームへと成熟する分解経路と形質膜と融合して細胞外小胞(エンドソームで形成される細胞外小胞はエクソソームとも呼ばれる)を放出する経路へと分かれる57, 58).MVEs形成機序にはエスコート複合体に依存する機序と依存しない機序が存在し,後者においてセラミドは必須の因子と考えられている57, 58).
エンドソーム膜へのセラミドの供給の仕方には少なくとも2通りの経路,すなわち,エンドソーム膜のSMをSM加水分解酵素nSMase2がセラミドに変換することで供給する経路と59),ERで新合成されたセラミドをCERT依存的にエンドソーム膜へと供給する経路が存在することがわかってきた46, 60, 61).PI4K2AによるPI4P合成が起きるエンドソーム膜にPI4P結合性PHドメインを持つCERTがリクルートされることで,ER–エンドソームMCSsで働くようになるのであろう61).内腔小胞形成に利用されたセラミドは細胞外小胞に乗って放出されてしまうため,CERTが仲介するERからエンドソームへのセラミドの流れも下り坂方向と解釈できる.
3)ステロール/PI4P交換転送とPI代謝との連携が生み出すステロールの上り坂移動
さまざまなオキシステロール類を結合する細胞質ゾルタンパク質として同定されたオキシステロール結合タンパク質(oxysterol-binding protein:OSBP)は,どのタイプの哺乳動物細胞でも広く発現している主要なステロール転送タンパク質である.OSBPは,PI4P結合性のPHドメインとVAPと結合するFFATモチーフを持ち,これらドメイン・モチーフは構造的にCERTのそれらに類似している.一方,OSBPのLTDであるOSBP関連ドメイン(OSBP-related domain:ORD)はSTARTドメインとは構造的に異なり,OSBPはヒトのOSBP関連タンパク質群(OSBP-related proteins:ORPs)や出芽酵母のOshタンパク質群とともにORDを持つLTPsのファミリーを構成している62–64).
酵母Osh4p(Kes1pとも呼ばれる)はORD以外のドメインを持たず,その三次元構造がいち早く明らかにされ65),その後,Osh4pはステロール以外にもPI4Pを封入できることが判明した66).このPI4P封入機能は他のいくつかのORDsでも示されている67–70).
コレステロール生合成の場はERであるが,細胞内のコレステロール濃度はERでは低く,ゴルジ体や形質膜の方がむしろ高い1).ERで合成されたコレステロールを濃度勾配に逆らってゴルジ体や形質膜へと上り坂移動させる機序は,異なるオルガネラ間の脂質交換と脂質代謝反応との間接的な連携である(図4A)66, 68).
ERに存在するPI4P脱リン酸化酵素SAC1の反応でER膜上のPI4P濃度は低く保たれているため,PI4Pを合成するオルガネラ(たとえば,形質膜やゴルジ体)からERへのPI4P転送は濃度勾配に沿った下り坂の移動となる.一方で,ERで生じたPIがPI転送タンパク質(PITP)によってゴルジ体や形質膜に転送されると,受容オルガネラ膜局在性PI4KによってATPを消費しつつPI4Pに変換されるため,ERからのPI転送も濃度的に下り坂の向きとなりえる.ここで述べたOSBP, PITP, SAC1, PI4Kからなるシステム全体での物質やエネルギーの収支をみると,ATPを消費しつつコレステロール(出芽酵母の場合はエルゴステロール)を濃度勾配に逆らってERから他のオルガネラに転送するシステムとなっている(図4A).
また,OSBPはRab11結合タンパク質RELCH依存的におそらくリサイクリングエンドソームからTGNへのコレステロール転送も仲介するが71),この転送方向が下り坂であるのか,それともTGNに存在するPI4Pとの交換転送を伴う上り坂であるのかは判然としていない.ORP2の場合,ER–形質膜間でコレステロールとPI(4,5)P2とを交換転送している72, 73).
特定の脂質をホスホイノシチドとの交換転送およびその代謝とリンクして上り坂移動させる機序は,ヒトORP5とORP8(出芽酵母のオーソログはOsh6pとOsh7p)がPSをERから形質膜へ転送するとき(図4B)69, 70, 74),ORP5がPSをERから脂肪滴へ転送するとき75),ORP9–ORP10複合体がPSをERからエンドソームもしくはTGNへ転送するとき76, 77),でも作動している.なお,ORP5/8がER–ミトコンドリアMCSsで働く際には78, 79),PSはミトコンドリア内では脱炭酸されてPEに変換されることを考えると(図1B),ERで合成されたPSをPI4Pとの交換転送なしにミトコンドリアへと下り坂方向で転送しているのかもしれない.
4)PITPが仲介するPIと他のリン脂質との交換転送
PI転送活性を持つPITPは複数知られており80),ERからゴルジ体へのPI転送にはNir2(PITPNM1, RDGB1とも呼ばれる)が関与すると示唆されている81, 82).Nir2は,N末端領域にLTDとFFATモチーフを持ち,C末端領域にはホスファチジン酸(PA)と結合するLNS2ドメインを有する(図4B).Nir2は成長因子刺激に応答して核周囲のゴルジ体領域から形質膜へと分布を変え,この形質膜への分布にはLNS2ドメインと隣接するDAG結合セグメントが必要である(図4B)83, 84).Nir2は,ERとゴルジ体の間でPIとPCを交換し82),ERと形質膜の間ではPIとPAとを交換する[ER–形質膜間PI/PA交換転送はNir3(PITPNM2, RDGB2とも呼ばれる)も行う](図4B)83–85).なお,ERから形質膜へ移動したPIはPI4PやさらにPI(4,5)P2へと変換され,一方,形質膜からERに運ばれたPAはPI合成に再利用されうる.よって,PI, PAどちらも濃度の低いオルガネラ方向にNir2/3を介して転送されているとの解釈が可能である(図4B).PCはどのオルガネラでも豊富に存在するため,Nir2が仲介するER–ゴルジ体間PI/PC交換転送におけるPCの転送方向が下り坂に相当するのかどうかの推定は難しい.
なお,ORPsやNir2/3のように異なる脂質クラスの膜間交換転送を触媒するLTPsは,一方の基質脂質の膜間濃度差がもう一方の基質脂質に比べて大きい場合,前者の下り坂移動に共役しながら後者の上り坂移動を駆動できる.ただし,このタイプのLTPsでも交換転送を伴わずに特定脂質をその濃度勾配に沿って膜間転送することはできる.また,交換転送する活性を持たないLTPsでは基質となる脂質をその濃度勾配に従って転送していると考えられ,たとえばStARkin/VASt/Asterドメインを持つLTPsが形質膜からERへとステロールを下り坂転送することが示されている86–89).
5)多種類脂質転送
上述したLTDsは,脂質の疎水性部位だけでなく,その親水性の極性頭部も認識することで特定の脂質タイプを選択的にドメイン内に封入する.一方で,脂質の極性頭部は細胞質ゾルに出したまま疎水性部位のみ中に収めることでさまざまな脂質種の膜間転送を触媒できるLTDsも存在する.
SMPドメインは,出芽酵母Mdm12タンパク質と配列相同性がある約200アミノ酸からなるドメインとして見いだされた90).Mdm12pは,酵母のER–ミトコンドリアMCSsに形成されるエルメス(ER-mitochondria encounter structure:ERMES)複合体の構成因子の一つであり,ERMES複合体の他の構成因子Mdm1pとMdm34pもSMPドメインを持っている.ERMES複合体はER–ミトコンドリア間のリン脂質輸送を仲介すると考えられており,その構成因子のSMPドメイン含有タンパク質にin vitroで複数種類のリン脂質の転送活性が認められたため,SMPドメインもLTDの一種とみなされるようになった91–95).
1種類のSMPタンパク質で複数のリン脂質種を転送できるという特性は,SMPドメインが疎水性のU字溝様の構造を持つLTDであることに起因している.ERMES複合体においては,SMPタンパク質のオリゴマーがMCSsに疎水性の溝を形成し,そこに脂質のジアシル部分が挿入されてスライドしながら膜間転送すると考えられており,極性頭部分の多少の構造差は許容される(図3,下段右も参照)91–95).この様式の脂質移送は,ERから多種類の主要リン脂質を大量に移送する必要がある場合に,たとえば膜自体が増えなければならないミトコンドリア増殖期などに,特に合理的な様式といえよう.
ERMES複合体が仲介する各リン脂質種の移送方向についても,ERで新合成されるPCやPSはミトコンドリアへ,ミトコンドリアに運ばれたPSの脱炭酸によって生じるPEやミトコンドリア内で新合成されるホスファチジルグリセロールはERへとそれぞれ下り坂移動しているとの解釈が可能である.
なお,ヒトSMPタンパク質である拡張型シナプトタグミン,PDZD8, TMEM24などについては,疎水性溝スライド様式ではなく,一つのSMPドメインに複数の脂質分子を封入して膜間をシャトルするモデルが提唱されている96–100).
6)非平衡状態ゆえに維持される脂質の流れ
上述したように,異なるオルガネラ間での一方向性にみえる脂質の流れや脂質の偏った分配は,特定のオルガネラで起こる脂質代謝,さらには特定のタンパク質を特定のオルガネラに局在させる膜輸送などがオルガネラ間の脂質転送と間接的にリンクするからこそ定常的に生み出されうると解釈できる.誤解されやすい以下の二点について追加の説明を加える.
“テスラバルブ”に代表される非対称構造を持つ流路では順方向と逆方向では流れの速さが異なる.しかし,順方向だからといって低い場所から高い場所に水が動かせるわけではない.低位置から高位置に物を動かすには別のエネルギーを付与する必要がある.同様に,LTP構造の非対称性に起因して,脂質転送の速さが向きによって変わることはありうるが,それだけで上り坂の向きに脂質を動かせることはない.
また,本稿で便宜上使った「脂質の濃度」についても,より正確には脂質分子の化学ポテンシャルとして議論する必要がある.特定の脂質分子と親和性の高い物質が受容膜に選択的に存在しているときなどは,供与膜よりも受容膜に多く分布する状態が熱力学的平衡となる.たとえば,哺乳動物細胞において,コレステロールは形質膜の外側半葉に多く分布している(総説101)で紹介されているように異論もある).ERで合成されたコレステロールが濃度勾配に逆らって形質膜に転送することは先述したPI代謝との間接的な連携機序で説明できるが,さらに,外側半葉に非対称に分布するには別の事柄が関わる.SMはゴルジ体内腔で合成されて小胞輸送で形質膜に運ばれるため,形質膜の外側半葉に多く分布する1).そして,コレステロールは他のリン脂質に比べてSMとの親和性が強いため(この原因はコレステロールの共存によってSMどうしの水素結合が安定化すると示唆されているが102),極長鎖アシル基を持つSM分子種には同じ半葉にコレステロールをとどめる作用がない103, 104)),コレステロールの濃度としては外側半葉に高くなっている状態が区画間での化学ポテンシャルの差がなくなった状態,つまり,熱力学的平衡状態と考えられる.実際,形質膜のSMを減少させると形質膜にコレステロールがトラップされなくなる105–107).なお,形質膜内側半葉のコレステロールレベルを低く維持するには,ATPを消費してコレステロールを形質膜の内側半葉から外側半葉にくみ出すトランスポーターや形質膜からERへとコレステロール転送するLTPの寄与も重要である108).
LTPsの活性制御の仕組みはまだあまりわかっていない.しかし,STARTドメインの名前の元となっているStARは副腎皮質ホルモン合成時に誘導されるリン酸化タンパク質として当初記述されたように109),リン酸化によって活性制御を受けるLTPsは複数知られている4).本章では,比較的詳細に解析されているCERT機能のリン酸化制御について紹介する.
CERTには少なくとも二つのリン酸化調節部位が存在する(図2A).二つの部位のうちの一つは,PHドメインの下流に位置しているセリンリピートモチーフ(serine repeat motif:SRM)である110).このSRMではセリン132がタンパク質キナーゼDによってリン酸化されるとその下流のセリン/トレオニン残基がカゼインキナーゼ1γによって順次リン酸化される111–113).SRMが多重リン酸化されるとCERTが持つPI4P結合活性とセラミド転送活性を同時に抑制することから,PHとSTARTの両ドメインが互いに他方をマスクするようにコンホメーション変化が起きると示唆されている(図2A,挿入図)34, 110, 114).
CERTをコードするヒト遺伝子におけるミスセンス変異が常染色体優性(顕性)遺伝をする先天性精神発達遅滞と強く連関することが見いだされ115),調べられた範囲内で,これらミスセンス変異はSRM多重リン酸化を介したCERT機能の抑制制御を破綻させることが明らかとなった43, 44, 116).抑制制御されずに異常に活性化したCERTがもたらす何らかの作用が精神発達遅滞の原因となっているのであれば,CERT機能を正常レベルに抑える薬剤によってこの遺伝病が緩和できるようになるかもしれない.
CERTのもう一つのリン酸化部位はFFATモチーフの少し上流に位置しているセリン315(S315)である(図2A)117).CERTは典型的なFFATモチーフ配列(EFFDAxE)を持つのでそのままでもVAP結合活性を検出できるが26),S315のリン酸化が起こるとFFATモチーフに依存したCERTのVAPへの結合能が著しく高まり,それによってセラミドのER–ゴルジ体間転送が促進される117).CERT S315のリン酸化・脱リン酸化に関与するキナーゼやホスファターゼの種類はまだ特定されていない.FFATモチーフ配列中の酸性アミノ酸の一部がセリンまたはトレオニンになった非典型モチーフしか持たないLTPsの中には,当該セリン・トレオニンがリン酸化を受けることで典型的FFATモチーフの荷電特性に近くなり,VAPとの結合活性が生じる例もある118, 119).
スフィンゴ脂質合成阻害剤で細胞を処理すると,SRMリン酸化は減少する一方でS315のリン酸化が増加する110, 117).この現象は,不足するSMを補おうとCERTの機能を亢進させる方向にリン酸化状態が変化する代償反応を意味していると思われる.しかし,「SRMリン酸化低下とS315のリン酸化増加」が常に一緒に起こるとは限らない.HeLa細胞を高浸透圧刺激すると,SRMのリン酸化状態を変化させずにS315のリン酸化が顕著に亢進される120).S315リン酸化によってVAP親和性が高まるため,CERTのERへの分布も高浸透圧下で増すのであるが,その際,ER–ゴルジ体MCSsにではなく,ER全体の分布が増強するように観察される120).VAP結合能を持つタンパク質ホスファターゼPP2Cε(別名PPM1L)がCERT SRMの脱リン酸化に関与することは別途示されているので121),SRMが多重リン酸化状態にあるCERTはVAPと会合するとPP2Cεによる脱リン酸化を受けやすくなり,SRMが脱リン化されればCERTのPHドメインの活性も復帰してER–ゴルジ体MCSsにトラップされるようになるのかもしれない.
8. LTPsを介した脂質輸送と他の細胞機能との連携
オルガネラ間の脂質輸送とさまざまな細胞機能との連携も明らかになりつつある.
VPS13(A~Dの四つのアイソフォームが存在する)やATG2は,SMPタンパク質とはアミノ酸配列上の明確な類似性はないものの,膜架橋型の疎水性溝を形成して多種類の脂質群をスライド様式で転送するLTPsである91, 122–125).膜架橋型疎水性溝を介して大量のリン脂質が細胞質ゾル側半葉だけで行き来して内腔側半葉に供給されないとしたら,両半葉間のリン脂質量のバランスが破綻するはずである.この問題を生物は巧みに解決している.すなわち,ATG2が仲介するER–新生オートファゴソーム間のリン脂質輸送において,供与膜側,受容膜側それぞれに特異的に局在する脂質スクランブラーゼと機能連携することで膜の内外半葉間のリン脂質量を平均化していること126–130),また,VPS13Aが仲介するリン脂質輸送でも似たような機能連携があることが最近明らかとなった131, 132).
なお,VPS13Dはリン脂質だけでなくセラミドや単独の脂肪酸も転送でき133),また,血中でリポタンパク質間のコレステロールエステル転送を行っているSMPタンパク質・コレステロールエステル転送タンパク質はトリアシルグリセロールやPCも封入できる134).よって,脂質の極性部位構造の選別能が低いLTPsはリン脂質を超えて多様な脂質群の転送に関わっている可能性がある.
さまざまな生体物質を分解処理する場であるリソソームの膜が損傷して内容物が細胞質に流れ出すようなことは細胞にとって緊急事態であり,何らかの対応を速やかに行う必要がある.損傷リソソーム膜の修復対応に複数のLTPsが関わっているとわかってきた135).すなわち,膜損傷に起因するリソソームからのCa2+流出を感知してPI4K2Aが損傷リソソーム膜にすばやくリクルートされてPI4Pを生産し,それを足掛かりにPI4PとVAPへの結合性モジュールを併せ持つコレステロール/PI4P交換転送型OSBPやPS/PI4P交換転送型ORP9–ORP10複合体,さらにはPSで活性亢進されるATG2がリクルートされてきてER–リソソームMCSsを安定化させるとともに,膜修復に必要な脂質群をERから供与する135).
ERとエンドソームとの間にもMCSsがあると認識されるに従い,複数のLTPsがエンドソームの成熟化や動態に寄与していることもわかってきた(この話題については最近の総説136)に詳しい).本稿では,紙幅の制限もあり,一例のみを簡単に紹介する.
細胞外から取り込んだ低密度リポタンパク質由来のコレステロールはエンドソーム・リソソームからERまたは形質膜へと移動して利用される137).ORP1Lはエンドソーム・リソソームからERへのコレステロール転送をしているLTPである138).ORP1LはそのORDにコレステロールを封入しているときとそうでないときとで自身のコンホメーションを変えつつ機能連携する相手をスイッチし139),その結果として,エンドソームの微小管上の動きやエンドソームの成熟化・機能分化が制御されている140).また,OSBPと同様のステロール/PI4P交換転送の活性を持つORP1Lは,ER–リソソーム–ミトコンドリアの三者からなるMCSsにおいてリソソームからミトコンドリアへPI4Pを転送し,ミトコンドリア分裂に寄与していると示唆されている141).
9. ウイルスや細菌による宿主LTPsのハイジャック
ウイルスや細胞内寄生性の細菌などは宿主側が合成した低分子をしばしば利用している142–144).水溶性低分子であれば宿主細胞質を単純拡散しても病原体に届くであろうが,宿主の膜上で合成された脂質分子がどのようにして病原体に届くのかは謎であった.しかし,LTPsをハイジャックすることで宿主由来の脂質の行先を病原体自身やその複製場の膜に向けなおしている例が数多く見つかりつつある145).
RNAウイルス感染細胞では複製膜複合体(replication membrane complex:RMC)と呼ばれる特殊な膜構造が形成され,その内部もしくは近傍でウイルスゲノムが複製される.C型肝炎ウイルス(HCV)のRMCはERに由来しながらもコレステロールやSMを豊富に含む界面活性剤耐性脂質膜(“脂質ラフト”とも呼ばれる)の性質を有する146, 147).HCVゲノムがコードする非構造タンパク質NS5Aが宿主PI4KAを結合してRMCにリクルートし,その結果,RMC上で(OSBPのPHドメインの結合リガンドであるとともにOSBP ORDによるコレステロールとの交換転送の基質でもある)PI4Pが合成され148, 149),ERとRMCの間でOSBPやNir2を介したコレステロール/PI4P交換やPI転送が起きてコレステロールがRMCに供給される150).
HCVの複製にはさらに多くのLTPsが関与しているようで,OSBPやNir2以外にも促進的に働いていると解釈されるLTPs151, 152),逆に抑制的に働いていると解釈されるLTPs153),さらにはCERTのように両方の解釈がありえるLTPもある147, 152, 153).
ポリオウイルスなどのピコルナウイルス類の場合,ウイルスゲノムがコードする3Aタンパク質がまず宿主細胞のアシルCoA結合ドメインタンパク質3(acyl CoA-binding domain protein 3:ACBD3)を結合し,次いでACBD3にPI4KBが結合することでRMC上にPI4Pを生産させ,OSBPを介したコレステロール転送を惹起するとされている154–156).なお,コレステロールはポリオウイルスゲノム複製に必要なウイルスプロテアーゼの活性化因子として機能する157).
結膜炎,肺炎や性器感染症を起こす病原体であるクラミジアは,生物分類上こそ真正細菌であるものの動物細胞内でしか増殖できない偏性細胞内寄生というユニークな性質を持ち,その増殖に必要な低分子の多くを宿主細胞に依存する.そして,クラミジアが封入体と呼ばれる膜構造を宿主細胞内で形成してその中で分裂増殖する際には,宿主CERTが必要である158–160).ER–封入体MCSsにおいて,封入体膜タンパク質IncDがERに会合しているCERTのPHドメインに結合することで,宿主ERで合成されたセラミドを封入体膜へ転送するように仕向けている159, 161).封入体に移行したセラミドはおそらくクラミジアに由来する酵素でSMへと変換される160, 162).
COVID-19を契機として,重篤な感染症に対しては病原体ゲノムのコードする因子だけでなくヒト因子を含めて分子標的を探る機運が広がっており,LTPsも抗感染症薬の分子標的となるかもしれない.
直近の10年間でオルガネラ間脂質輸送をつかさどるLTPsの研究は大きく進展した.しかし,さまざまな事柄が依然として未解決である.CERTを含めてLTPsの活性制御の詳細な仕組みや,LTPsを介した脂質輸送と他の細胞機能との連携の仕組みは今後とも地道に解き明かしていくべき課題である.
ゴルジ体はシス・メディアル・トランスと呼ばれる複数の嚢から構成され,エンドソームにも初期・後期・リサイクリング・ソーティングといった複数のタイプがあって,それぞれに異なる機能を持っている.よって,MCSsを解析する際に超解像顕微鏡などを駆使してオルガネラをサブカテゴリーレベルまで区別することも求められていくであろう.
また,特異性の高い阻害剤の開発も必要である.LTPsが細胞内脂質代謝に重要な位置を占めていることが明らかになるにつれ,LTPsはヒトの健康や病気における新しいタイプの医療用分子標的としてみなされてきている.しかし,LTPの化学的阻害剤は少数のLTPを除いてほとんど開発されておらず,複数種類の阻害剤が開発されているCERT163–165)やOSBP166–169)でさえもそれら既存阻害剤の分子標的特異性や動物個体レベルにおける安全性の評価は現状不十分と思われる.
さまざまな生物の全ゲノム配列が決定され,バイオインフォマティクス技術も発展していく中でLTDを持つタンパク質の候補リストは増え続けている.しかし,LTPの生化学的特性を満たしているものの,細胞中に比較的大量に存在するアシルCoA結合タンパク質や脂肪酸結合タンパク質の本来の役割はそのままでは細胞毒性を発揮してしまう両親媒性低分子を封入して保管し,必要に応じて脂質代謝酵素に引き渡すことにある.さらに,膜や酵素への脂質転送ではなく,当該タンパク質機能の制御のために脂質をリガンドとして結合するというタイプの“LTPs”も存在する170).よって,LTPと注釈されたタンパク質の生理的な役割を解き明かすにはいろいろな角度からの検討が今後も不可欠である.
脂質生物学と分子動力学のような計算科学との連携にも期待したい.しかし,現在の生物系の分子動力学解析では水分子の動きは対象外にしていると聞く.疎水性相互作用は水分子の動きが関与するエントロピー駆動的な事象であるので,脂質のような疎水性生体分子の挙動を適切に計算予測するには水分子も含めて計算する必要があるのではなかろうか.また,多因子が相互に関連しあって定常状態を維持している代謝の仕組みをより深く理解するにはシステム生物学分野との連携も必要と思われる.
筆者は大学院時代にNa+とシンポートしてアミノ酸を取り込む大腸菌膜タンパク質の生化学的研究に携わり,学位取得後は哺乳動物細胞におけるスフィンゴ脂質代謝の研究に取り組み,その延長上でCERTを発見するに至った.四十年間近い自身の研究生活の多くを膜内または膜間の低分子輸送という課題に費やしたことになる.Metabolismという言葉には化学変化を伴う生体事象という含意があるため,化学構造の変化を伴う過程しか代謝マップに記載されていないことがある.しかし,人間の生活に必要な「物」について,その生産地と消費地のことだけでなくその間の物流を含めて考えなければ「物」のライフサイクルを語れないように,細胞内といった微視的な領域においても生きた状態を維持するには必要な「物」を必要とされる場所に時間を見計って過不足なく届けるロジスティクスが不可欠のはずである.今後は,脂質分子の細胞内輸送過程も含めた包括的な代謝マップへと進化していくことを期待している.