表1 主なKVチャネルおよびその関連研究の年表| 1952年 Hodgkin–Huxley方程式1) |
| 1963年 HodgkinとHuxleyノーベル生理学医学賞受賞 |
| 1976年 初のシングルチャネル記録(アセチルコリン受容体)10) |
| 1984年 電気ウナギから初のNaVチャネルのクローニング11) |
| 1987年 Shaker(KVチャネル)のクローニング15–17) |
| 1990年 Shakerチャネルの不活性化(ball and chain)モデル40, 41) |
| 1991年 Slo(BKチャネル)のクローニング26),NeherとSakmannノーベル生理学医学賞受賞 |
| 1993年 Kirチャネル遺伝子のクローニング27–29) |
| 1994年 Zagotta–Hoshi–Aldrichモデル42–44) |
| 1996年 ShakerチャネルのVCF55) |
| 1998年 KcsAチャネルの結晶構造61) |
| 2003年 KvAPチャネルの結晶構造67, 68),MacKinnonノーベル化学賞受賞 |
| 2005年 HV1(VSOP)の発見34, 35),Kv1.2チャネルの結晶構造69, 70) |
| 2012年 KVチャネルのMDシミュレーション76) |
| 2013年 cryo EMによるTRPV1チャネルの構造78) |
| 2015年 Slo2.2の構造(cryo EM)88) |
| 2016年 Eagチャネルの構造(cryo EM)82) |
| 2017年 Slo186, 87),hERGチャネル83),KCNQ1の構造(cryo EM)84) |
| 2021年 Kv4.2チャネルの構造(cryo EM)91) |
| 2022年 Kv3.1チャネルの構造(cryo EM)93) |
| cryo EM:クライオ電子顕微鏡. |
イオンチャネルは,細胞膜を介したイオンの輸送(電気化学勾配に従った拡散)に関わる膜タンパク質である.そのさまざまな生理機能のうち最も重要なものの一つとして,神経細胞や筋細胞における活動電位の生成があげられる.これらのいわゆる興奮性細胞では,細胞内は通常−70 mV程度の負の電位(静止膜電位と呼ばれる)を保つが,何らかの刺激により電位依存性ナトリウム(NaV)チャネルが開口すると,細胞外よりナトリウムイオン(Na+)が流入し,細胞内電位が正の値に転ずる(Na+の濃度は,細胞外の方が細胞内よりも10倍程度高いため,NaVチャネルが開くとNa+は細胞内へ流入する).これを脱分極と呼び,それによって生じる一過的な電位変化を活動電位と呼ぶ.活動電位は神経細胞の電気シグナルそのものであるし,また筋細胞においては収縮のトリガーとなる.活動電位が発生すると,遅れて電位依存性カリウム(KV)チャネルが開口する(並行してNaVチャネルは不活性化状態となり,Na+の流入は止まる).K+の濃度は,細胞内の方が細胞外よりも数十倍程度高いため,KVチャネルが開くと,K+は細胞外へと流出する.同じ正電荷のイオンであるが,流れる方向がNa+とK+では逆方向になるため,KVチャネルの開口は活動電位を抑える方向に作用し,最終的に細胞を静止膜電位に戻す.なお,静止膜電位が負の値を持つのは,細胞膜が常にK+をある程度透過するためであるが,これは後述するKVチャネルとは異なるタイプのK+チャネル,内向き整流性K+(Kir)チャネルが常時開口しているためである.
このようにNaVチャネルとKVチャネルが協同的に働くことで,活動電位が生成される.これらイオンチャネルの働きに異常が生じると,てんかんや不整脈といった,神経や心筋,骨格筋などの疾患を起こす可能性がある.したがって,イオンチャネルの基本構造と機能を理解することは,基礎医学のみならず,創薬や臨床応用にもつながる非常に重要な課題である.
活動電位の振る舞いに関しては,1930~50年代における多数の生理学者の研究成果を通じ,最終的にHodgkinとHuxleyが見事に数学的に表現することに成功した(Hodgkin–Huxley方程式)1).この成果により,Hodgkin, HuxleyはEcclesとともに1963年のノーベル生理学医学賞を受賞している.Hodgkin–Huxley方程式では,NaVチャネル電流(INa),KVチャネル電流(IK)とリーク電流(Il)の3種類の電流の振る舞いを数学的に記述し,活動電位の再現に成功している.NaVチャネル電流(INa),KVチャネル電流(IK)の数学的な表現については,彼らがイカの巨大軸索から膜電位固定法により実際に得た詳細なデータがもとになっている2–5).
この時点では,分子実体としてのイオンチャネルは知られておらず,あくまでNa+あるいはK+の透過性(コンダクタンス,gNa,gK)という形で表現されていた.それにもかかわらず,gKには四乗の項(n4)が含まれており1),四つの独立した“gating particle”すべてが活性化することで初めてK+電流が流れることを示している.のちに詳しく述べるが,KVチャネルの開口には四つのサブユニットがそれぞれ活性化する必要があることと関係がある.ちなみにgNaはm3hと表現されている.gNaは不活性化するため,活性化に関わる“gating particle”をm,不活性化に関わる“gating particle”をhと表現している.実際NaVチャネルのアイソフォームによって若干の違いはあるものの,一つのサブユニット内に含まれる四つの電位を感知する領域(電位センサー)のうち,三つが活性化に,残る一つが不活性化に関わると考えられており6–9),こちらに関しても当時のモデルが驚くほど正確にNaVチャネルの性質を表現しているといえる.
その後,さまざまな細胞でIKが記録されるようになった.特にNeherとSakmannにより開発されたパッチクランプ法は画期的な手法であり,これによりガラス電極の先端の膜(直径1 µmほど)に存在するわずか1個のイオンチャネルの電流を記録することができるようになった10).そしてこの1個のイオンチャネルからの電流,すなわちシングルチャネル記録においては,電流が0か1かのデジタル的な振る舞いをしていることがわかった.つまりイオンチャネルは閉状態と開状態の間を行ったり来たりすること,そして開状態にいる確率(開確率)は電位に依存して変化することが明確にわかったのである.またシングルチャネル電流の大きさは通常pAレベルであるが,ここから1個のイオンチャネルが,一定時間あたりどの程度のイオンを通すのかを計算することもできるようになった(たとえば1 pAのK+電流が1ミリ秒間流れたとすると,その間におよそ6000個(10−15クーロン)のK+が流れていることになる).こういった技術の進歩により,機能分子としてのKVチャネルの姿,性質が徐々に明らかになっていったと思われる.しかし,その当時はあくまで細胞にもともと存在している内在性KVチャネルの研究であり,純粋にKVチャネル分子を対象とする実験には,遺伝子クローニングを待たなければならなかった.
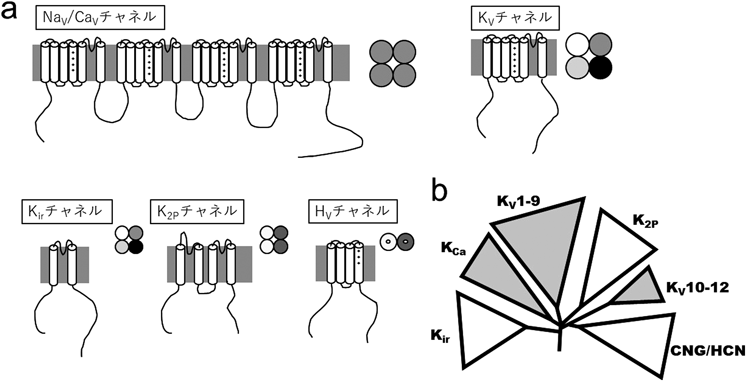
KVチャネルの遺伝子がクローニングされる前に,1984年に初めての電位依存性イオンチャネル遺伝子として,電気ウナギ(Electrophorus electricus)のNaVチャネルの遺伝子が京都大学の沼と野田らのグループによってクローニングされた11).これは電気ウナギの発電器官に豊富に発現しているNaVチャネルをタンパク質として精製し,そのアミノ酸配列を手がかりに同定したものであった(沼と野田らはその前にも,同様の手法でシビレエイTorpedo californicaの電気器官よりアセチルコリン受容体のα, β, γサブユニット遺伝子をクローニングしている12, 13)).同定されたNaVチャネルは,1820ものアミノ酸残基からなる巨大なタンパク質であった(図1a).そして四つの相同なユニット(ドメイン)から構成されることや,それぞれのドメインには正電荷アミノ酸(主にアルギニン)のクラスターが存在することもわかり,これが電位依存的な開閉(ゲーティング)に関わっていると予想された11).
NaVチャネルの遺伝子配列が発表されるよりも以前に,ショウジョウバエのある変異体が,麻酔下で脚を振るわせる特徴的な表現型を持つことが知られており,その遺伝子はShakerと名づけられていた.SalkoffとWymanは,Shaker変異体が,ショウジョウバエ(Drosophila melanogaster)幼虫の運動神経のKV電流に影響があることを示した14).その後,TanouyeらのグループとYuh Nung JanとLily Janらのグループは,それぞれ染色体ウォーキング法という同一の手法を用い,最終的にショウジョウバエからKVチャネルの遺伝子をクローニングすることに成功し,1987年に発表した15–18).
NaVチャネルの遺伝子が四つの繰り返しドメインからなる巨大な構造だったのに対し,KVチャネルの遺伝子はNaVチャネルのドメイン一つ分に相当する構造を持っていた(図1a).アミノ酸配列の疎水性などから,当初7回膜貫通タンパク質であると予想されたが,最終的に6回膜貫通タンパク質であることが判明した.六つの膜貫通領域はそれぞれS1~S6セグメントと呼ばれるが,中でも4番目の膜貫通領域(S4セグメント)には3つのアミノ酸残基ごとに正電荷を持つアミノ酸が配置されており,NaVチャネルと同様にこれらが電位依存的な活性化の構造基盤となっていることが予想されていた16).
得られたShakerのcDNAからin vitroでcRNAを合成し,そのcRNAをアフリカツメガエル(Xenopus laevis)の卵母細胞に注入したところ,速い不活性化を特徴とするK+電流が記録された19).これ以前の,神経細胞や筋細胞,卵などから得られた電気生理学的測定においては,それぞれの細胞がさまざまな種類のイオンチャネルを発現しているため,薬理学的に区別する(阻害剤が存在する場合),細胞内外のイオン組成を変更する(流したくないイオンを他のイオンに置換する),測定プロトコールを工夫する(電位依存的活性化,不活性化がイオンチャネルの種類によって異なることを利用する)などの方法を駆使することで電流を分離し,研究が進められてきた.しかしながら,アフリカツメガエル卵母細胞などの発現系が確立して以降,個々のイオンチャネルを過剰発現する細胞を利用することにより,イオンチャネル研究は格段に進めやすくなったといえる.アフリカツメガエルの卵母細胞にも内在性の電流は存在するが,多くの電位依存性チャネルの研究に用いられる−80 mV~+60 mVあたりのレンジでは内在性電流は比較的小さい.またShakerチャネルが単独でアフリカツメガエル卵母細胞の細胞膜上によく発現することも研究が捗った理由である[NaVチャネルや電位依存性カルシウム(CaV)チャネルなどの場合,主サブユニット(αサブユニット)に加え,β, γサブユニットなどと呼ばれる複数の異なる副サブユニットが発現に必要な場合が多い].そしてKVチャネル研究が進展したもう一つの重要な要素は,TanouyeらやJanらが,Shaker遺伝子を世界中の他の研究者グループに積極的にシェアしたことにある20).これにより,イオンチャネル分子の研究がShakerチャネルを中心に進んでいくこととなった.
アミノ酸配列がわかったことにより,点変異体の機能解析などによりさまざまなアイデアをテストすることができるようになった.たとえばS4セグメント上に存在するいくつかの正電荷のアミノ酸残基[アルギニン(R),リシン(K)]を,電荷を持たないグルタミン(Q)などに置換することで,これらの正電荷アミノ酸が実際に電位依存性ゲーティングに寄与することが示された21).
また,アミノ酸配列の相同性をもとに,ヒトを含めた哺乳類からShakerの相同遺伝子,あるいはその関連遺伝子が次々とクローニングされ,トップジャーナルを賑わせた22–24).そのような状況で,SalkoffらはショウジョウバエからShaker遺伝子と相同性を持つ三つの新しいKVチャネル遺伝子を同定した.これらはShab, Shaw, Shalと名づけられたが,のちにShaker(Kv1)と合わせてKv2, 3, 4とそれぞれ名づけられた.KV遺伝子ファミリーに関しては現在Kv1~12まで存在し,それぞれのサブファミリーを合わせるとヒトには40種類のKV遺伝子が存在する25).ただし分子系統樹でみると,Kv10~12はむしろCNG/HCNチャネルに近い(図1b).ちなみにCNG/HCNチャネルはKVチャネルと同様6回膜貫通型のタンパク質であるが,K+選択性のない,細胞内リガンド(環状ヌクレオチド)あるいは過分極で開く非選択性陽イオンチャネルである.
さらに,古典的なKVチャネル以外のK+チャネルも新しく遺伝子が同定されていった.同じくショウジョウバエの変異体sloからは細胞内Ca2+濃度の上昇によって活性化するK+チャネル遺伝子が同定された26).このSloチャネルは,非常に大きなコンダクタンス(~250 pS)を持つため,のちにBK(Big K)チャネルと名づけられた.このファミリーにはIK(Intermediate K),SK(Small K)などコンダクタンスの大きさなどが異なる八つの遺伝子が含まれている.またS1~S4セグメントを含まず,S5~S6(ポアドメイン)相当の2回膜貫通タンパク質であるROMK, IRK, GIRKの各遺伝子が1993年に相次いで同定された(図1a)27–29).これらは内向き整流性K+(Kir)チャネルと呼ばれるグループであり,現在はKir1~7と名づけられている.Kirチャネルは,神経細胞や心筋細胞などにおいて静止膜電位を安定化させるなどの生理機能を持つ.電位センサードメインを欠くことから,チャネルタンパク質自体は電位依存的な開閉機構が存在していないが,細胞内側のMg2+やスペルミンなどが電位依存的にイオン透過路をブロックすることによる強い内向き整流性(外向きに流れにくい性質)を示す30, 31).1996年には,Kirチャネルが二つ直列でつながったような構造を持つ,弱い内向き整流性を示す4回膜貫通の新しいグループが発見され,のちにTwo-pore domain K+(K2P)チャネルと名づけられた(図1a)32).2005年に電位センサードメイン(S1~S4)にホスファターゼがつながった膜タンパク質VSPが,続く2006年には電位センサードメイン(S1~S4)のみでできた膜タンパク質(VSOP, Hv1)が報告された(図1a)33–35).これら新しい電位センサードメインタンパク質ファミリーの発見により,KVチャネルは電位センサードメインとポアドメインの二つの独立したユニットが結合してできたと考えられている.
3. KVチャネルの構造機能連関研究とゲーティングモデル
KVチャネルのアミノ酸配列から,KVチャネルの膜貫通領域等の二次構造情報が推定され,それを頼りに構造と機能の関係を明らかにする研究が進んだ.
まず一つ目はKVチャネルの四量体構造についてである.先にクローニングされたNaVチャネル11),そしてKVチャネルと同時期にクローニングされた電位依存性カルシウム(CaV)チャネル36)は,いずれも6回膜貫通のドメインが四つ直列につながった24回膜貫通のアミノ酸配列を持っているのに対し,KVチャネルは6回膜貫通ドメインを一つ持つのみであった(図1a).したがって,もしKVチャネルがNaVチャネルやCaVチャネルと共通の構造を持つのであれば,四つのサブユニットが集まって一つのイオンチャネルを構成するホモ四量体であることが予想された.その一方で,Shakerのクローニング後,相同配列を持ったKVチャネルの遺伝子が次々に同定されていったので,KVチャネルが異なる種類のサブユニット間でヘテロ四量体を作れるかどうかを試す実験が行われた37–39).2種類以上のKVチャネルのcRNAをアフリカツメガエルの卵母細胞に発現させると,混ぜて発現させたKVチャネルの中間的な性質(活性化,不活性化,電位依存性,阻害剤への感受性など)を持つ電流が得られる組合わせが発見され,少なくともサブファミリー内では(例えばKv1のサブファミリー内にはKv1.1~1.9の9種類の遺伝子が含まれる)多くの場合ヘテロ四量体を構成できることがわかった.さらにIsacoffとJanらは,2種類の遺伝子(Shakerチャネルの二つのスプライスバリアントShAとShB)をタンデム(直列)につなげることで,中間の性質を持つKVチャネル電流(タンデムコンストラクトの二量体)が生じることを示し,ヘテロ四量体が形成されることをより直接的に証明した38).
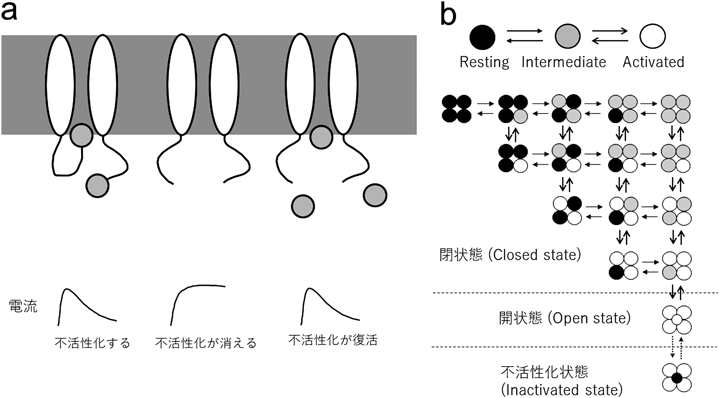
初期の構造機能連関研究で最もエレガントな研究の一つが,Zagotta, Hoshi, AldrichによるShakerチャネル不活性化の分子メカニズムの解明である40, 41).KVチャネルには不活性化するものと不活性化しないものがあるが,Shakerチャネルのスプライスバリアントの一つ,ShBは典型的な速い不活性化を示すKVチャネルである.Aldrichらは,細胞内N末端の20アミノ酸を削ると不活性化がまったく起こらなくなることを見いだした.さらに,このdeletion変異体に対し,この20アミノ酸からなるペプチドを投与すると,不活性化が復活することも示した(図2a).そこでAldrichらは,この20アミノ酸からなるドメインを“ボール”に見立て,N末端の先端に鎖でつながれた“ボール”がイオン透過路を塞ぐ“ball and chain model”を提唱した(この不活性化は“N型不活性化”とも呼ばれ,フィルター領域で起こる“C型不活性化”と区別される).Zagotta, Hoshi, Aldrichはさらにマクロ電流測定,シングルチャネル記録,ゲーティング電流(後述)測定を駆使し,Shakerチャネルの精緻なゲーティングモデル(3人の頭文字をとってZHAモデルと呼ばれる)を完成させた(図2b)42–44).KVチャネルの種類によって多少異なるものの,基本のゲーティングモデルとして広く受け入れられている.このモデルでは,四つのサブユニットが独立して動くと仮定し,Resting state, Intermediate state, Activated stateの三つの状態のいずれかをとりうると考える.膜電位が静止膜電位から脱分極するにつれ,Resting stateからActivated stateに遷移していく.四つすべてのサブユニットがActivated stateに入ることで,チャネルが開く.なお,Aldrichらが作製した“ILT”変異体(S4セグメントにV369I, I372L, S376Tの三つの変異を含む)では最後のステップが著しく阻害され,すべてのS4がActivated stateに入ってもすぐにはポアが開かないことから,通常KVチャネルが開く際には,すべてのS4が上がった後,もう1ステップ(final opening transition)が必要と考えられている45).Shakerは不活性化するKVチャネルなので,ZHAモデルでは,ポアが開いた後に不活性化ボールがポアドメインに入り込み,不活性化するところまでがモデル化されている(図2b)44).
4. KVチャネルの電位センサードメインの動きの検出
HodgkinとHuxleyの1952年の論文は,Na+やK+の透過性(gNa, gK)が上昇する際,細胞膜にかかる電場の変化に応じて電荷が動くこと,すなわちゲート電流が生じることを予言していた1).その後1970年代になって,ArmstrongとBezanilla,そしてKeynesとRojasの2組のグループが,初めて実際にイカの巨大軸索からゲート電流を記録することに成功した46–49).1980年代になってNaVチャネル,KVチャネル,CaVチャネルがクローニングされるようになり,4番目の膜貫通領域S4セグメントに存在する正電荷のアミノ酸残基がゲート電流を起こす電荷の源であると考えられるようになった.すでに述べたように,これらの正電荷のアミノ酸残基を,電荷を持たない他のアミノ酸残基に置き換えることで活性化の速度や電位依存性が変化したことから,少なくとも正電荷のアミノ酸残基が電位依存性ゲーティングに重要な役割を担っていることが確かめられた21).その後,アフリカツメガエルの卵母細胞に発現させたShakerチャネルからもゲート電流が記録できるようになった50, 51).これらの結果から,電位センサーが細胞膜にかかる電場を横切って動くことでゲート電流が生じることが強く予想されていたが,実際に本当に動くのかどうか,また動くとしてどの程度の動きがあるかについては,この時点ではまだわかっていなかった.
1992年にKarlinらは,ニコチン性アセチルコリン受容体(nAChR)のαサブユニットのM2(2番目の膜貫通領域)のアミノ酸を一つ一つシステインに変異させた変異体シリーズを作製し,MTSES, MTSETといったメタンチオスルホン酸誘導体を用いて,アセチルコリン存在下,非存在下におけるこれらのアミノ酸のアクセシビリティを評価した52).これらの化合物は水溶性であり,またシステイン残基のスルフヒドリル(SH)基を不可逆的に修飾する.したがって,これらの試薬を投与すると,システイン残基が水環境に露出しているときにだけ化学修飾が起きるため,構造変化に伴うシステイン残基の位置を間接的に捉えることができる.これにより,Karlinらは,アセチルコリンの投与によるnAChRの構造変化を間接的に捉えることに成功した.この方法をSCAM(substituted cysteine accessibility method)と呼ぶ.
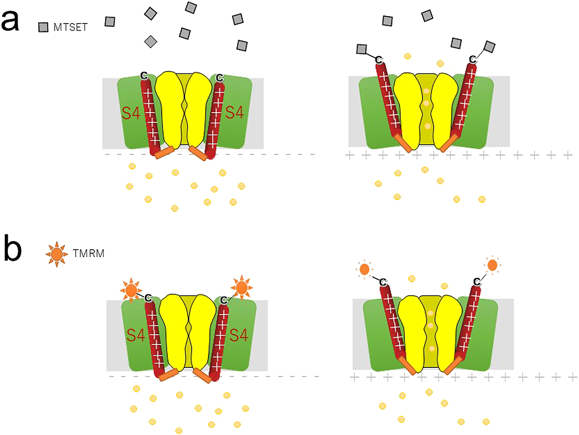
1995年にHornらは,SCAMを電位センサードメインの動きの検出に適用した.具体的には,ヒト骨格筋NaVチャネル(NaV1.4)のS4セグメントの細胞外側に一つシステイン残基を導入したR1448C変異体を作製し,この残基に対するアクセシビリティの電位依存性を評価した.すると,脱分極することでR1448Cに対する修飾速度が速くなることがわかり,実際にS4セグメントが電位依存的に細胞外に向けて移動することが示された(図3a)53).Isacoffらは,Shakerチャネルでも同様にSCAMを適用し,細胞外側だけでなく細胞内側のS4セグメントのアクセシビリティも評価して,静止膜電位では細胞内側への露出度が,脱分極時は細胞外側への露出度が大きくなることを示した54).
さらにIsacoffらは,蛍光分子でS4セグメントをラベルすることにより,より直接的にS4セグメントの動きを検出することに成功した55).この方法では,まず赤色の蛍光色素であるTMRM(tetramethylrhodamine-maleimide)を,SCAMのときと同様S4セグメント上部,あるいはS3~S4リンカーに導入したシステイン残基に結合させる.TMRMも水溶性であり,細胞膜は透過しないので,細胞外液に露出したシステイン残基のみが修飾される.このとき,100 mM程度の高K+溶液中で反応させると細胞が脱分極するため,S4が上がった状態になり,S4セグメントの真ん中あたりまで蛍光ラベルすることができる.その後反応しなかったTMRMをしっかり洗い流し,2本刺し膜電位固定法により電流測定を行いながら,蛍光強度変化を光電子倍増管(フォトマル)などで検出する.蛍光の強度は,周りの環境(親水性,疎水性など)に依存して大きく変化する.したがって,ちょうど細胞膜と細胞外液の境界あたりのシステイン残基をラベルすることができると,その付近の環境はS4セグメントの動きによって大きく変化するため,蛍光強度変化という形で構造変化をリアルタイムに検出することができる(図3b).この論文でも,M356CとA359CというS3~S4リンカーとS4セグメントの境界あたりを蛍光ラベルすることにより,最大で10%程度の蛍光の増減を検出することに成功している.この手法はvoltage-clamp fluorometry(VCF)と呼ばれ,イオンチャネルあるいは受容体の構造変化を捉える上で簡便かつ強力な手法である.TMRM以外にもAlexa-488 maleimideなど他の蛍光分子を使用でき,パッチクランプと組み合わせたpatch clamp fluorometry56),さらには非天然の蛍光アミノ酸(ANAP)を組み込ませる方法などのバリエーションが存在する57–59).
その他の手法として,Bazanillaらはランタノイドの一種テルビウムをドナー,そして蛍光分子のフルオレセインをアクセプターとしたLRET(lanthanide-based resonance energy transfer)を用いて,S4セグメントの動きが最大で3.2 Åであると推定した60).
1998年にMacKinnonらによって,初のイオンチャネルの結晶構造が発表された61).KcsAと名づけられたそのチャネルは,放線菌の一種Streptomyces lividans由来のpH依存的に開閉するK+チャネルである62).2回膜貫通型タンパク質であるαサブユニットが四つ集まって一つのチャネルを構成しており,内向き整流性K+チャネルと似た構造を持っている.3.2 Åで解かれたその立体構造は,四つのサブユニットが組み合わさった形となっており,その中央にカリウムイオンが一つ通る程度の大きさの穴,すなわちイオン透過路ができている.かつて多くのK+チャネル遺伝子がクローニングされていたとき,5番目と6番目の膜貫通領域の間のP-regionと呼ばれる領域には,GYG(グリシン–チロシン–グリシン)という非常に特徴的な三つのアミノ酸配列モチーフが存在することが知られていた.MacKinnon自身もこれらのアミノ酸に変異を入れ,K+の選択性に影響が出ることをKcsAチャネルの構造を発表する以前に報告している63).このKcsAチャネルの構造では,GYGモチーフはイオン透過路に沿って並んでいたが,イオン透過路を向いていたのは側鎖ではなく,主鎖のカルボニル基であった.Fab抗体を用いてさらに2.0 Åまで解像度を上げた続報においては,カルボニル基の酸素原子が8方向よりK+を包む様子がみえており,あたかもK+が水中で八つの水分子が集まって水和されているかのようであった64).この仕組みにより,選択性フィルター内の四つの場所にK+が安定的に存在できることがわかり,K+はその四つのサイトを1歩ずつ進んでいくことがわかった.MacKinnonはこれらの業績により,水チャネル(アクアポリン)を発見したAgreとともに2003年のノーベル化学賞を受賞している.
さらにMacKinnonらは,2002年にはMthKチャネルの結晶構造を発表した65).MthKチャネルは好熱性メタン細菌Methanobacterium thermoautotrophicum由来のK+チャネルで,細胞質側のRCK(regulators of K+ conductance)にCa2+が結合することによって開く.このRCKドメインは,同じくCa2+が結合することによって開くBKチャネルも持っている(BKチャネルは脱分極でも開く).先に報告されたKcsAは閉状態であったが,このMthKの構造は開状態であると考えられ,これによりチャネルの種類は異なるものの,閉状態と開状態のK+チャネルモデルが得られたこととなった66).
次にMacKinnonらは,初の電位センサードメインを持つK+チャネルの構造として,KvAPチャネルの結晶構造を発表した67).KvAPは好気性超好熱古細菌(Aeropyrum pernix)由来のタンパク質である.電位センサードメインの構造がどうなっているか,大変注目を集めたが,このKvAPの構造においては,S4セグメントが細胞膜を貫通しておらず,細胞内側の脂質と水の境界面に沿って完全に横に倒れている状態であった.これまでの実験結果の蓄積により,S4セグメントは細胞膜を垂直に貫通しており,それがシリンダー内で上下運動を繰り返すピストンのようなモデルが考えられていたため,当時発表されたKvAPの構造とは相いれなかった.そこでMacKinnonらはS3~S4を“パドル”状の構造と捉え,それがチャネルのポアドメインに沿って上下に運動する,“パドルモデル”を提案した67, 68).しかし,このモデルでは“パドル”のかなり大きな動きが必要であることから激しい批判があり,少なくともShakerチャネルをはじめとする一般的なKVチャネルには当てはまらないように思われた.そのような状況の中,2005年にMacKinnonとLongらは最初の哺乳類のKVチャネル(Kv1.2)の結晶構造を報告した69, 70).このKv1.2チャネルの構造では,KvAPとは異なってS4セグメントは膜を貫通して立っており,その上部は細胞外側に露出しているような構造をとっていた70).したがってこの構造はKVチャネルの開状態モデルとして,広く受け入れられた.MacKinnonとLongらは,さらにKv1.2のS3の一部とS4セグメント(パドル部分に相当)をKv2.1に入れ替えたKv1.2~2.1キメラの結晶構造解析を行うことで解像度を2.4 Åまで上げ,電位センサー内のアミノ酸側鎖間の相互作用まで鮮明に描き出すことに成功した71).これにより,S4セグメント上の正電荷を持つアミノ酸残基(主にアルギニン)が,S1やS2セグメント上に存在する負電荷を持つアミノ酸残基(グルタミン酸やアスパラギン酸)と塩橋を作っている様子もわかった.またS2セグメント上に存在するフェニルアラニン残基が,電位センサーのやや下側中心に存在していた.MacKinnonらはこのフェニルアラニン残基が,アルギニンが脱分極時に乗り越えることでゲーティングチャージが生じる場所,“チャージトランスファーセンター”として機能していることを実験的に示した72).
基本的にイオンチャネルの構造解析においては,膜電位が存在しない状態,すなわち0 mVでの安定構造をとっていると考えられる.膜電位が0 mVとはすなわち脱分極している状態であるため,KVチャネルのS4セグメントは細胞外に向かって上がった状態(up state)をとり,ゲートは開いた“開状態”と想定される.電位をかける必要があるため,電位依存性チャネルの閉状態構造を得ることは通常非常に難しい.しかし,開状態の構造をもとに,閉状態の構造モデルを作成する試みは行われてきた73, 74).その中でShawらは,Antonと呼ばれる分子動力学計算に特化した独自のスーパーコンピュータを用いて75),Kv1.2/Kv2.1キメラチャネルのゲーティングをシミュレーションした76).その中で,正電荷を持ついくつかのアミノ酸が負電荷を持つアミノ酸と塩橋を作りつつ,1ステップずつずれて移動していく様子が動画として鮮やかに描かれた.
2013年にChengとJuliusらが温度(あるいはカプサイシン)で活性化するTRPV1チャネルの構造を,クライオ電子顕微鏡による単粒子解析により3.4 Åの解像度で明らかにすることに成功した77, 78).単粒子解析によるイオンチャネルの構造解析は,2001年に佐藤らがすでに成功していたが(このときはNaVチャネルの構造)79),当時の解像度は19 Åであった.それから12年の間に,電子線を直接検知するCMOSカメラの登場や,二次元投影像を三次元に再構成するアルゴリズムの進歩などにより,解像度が大幅に上昇した.クライオ電子顕微鏡による生体分子の構造解析法の開発により,Dubochet, Frank, Hendersonの3名が2017年のノーベル化学賞を受賞している.JuliusもTRPV1をはじめとする温度感受性チャネル発見の功績により,機械受容チャネルPIEZO1とPIEZO2を発見したPatapoutianとともに2021年のノーベル生理学医学賞を受賞したことは記憶に新しい80, 81).
この技術は,従来のX線による構造解析とは異なりタンパク質の結晶を必要としないため,これまで結晶化が困難だった膜タンパク質の構造が次々と明らかにされていった.KVチャネルについても,Eag(Kv10.1)チャネル82),hERG(Kv11.1)チャネル83),KCNQ1(Kv7.1)チャネル84, 85),Slo1(BK)チャネル86, 87),Slo2.2(Na+-dependent K+)チャネル88, 89)などがMacKinnonのグループによって報告された.さらにここ2~3年ほどは,他のグループからもKVチャネルの新しい構造が報告されつつある90–95).
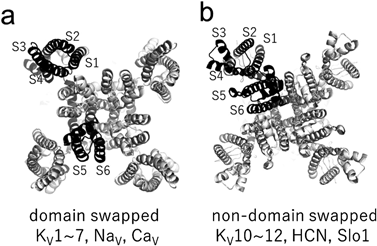
これまで同定されたKVチャネルの構造は基本的にすべて同じ四量体構造を持ち,中央にポアドメイン,周辺部に独立した電位センサードメインを四つ持っている.しかしながら四量体の組み上がり方には2種類あることがわかった.当初同定されたKv1.2をはじめ,Kv1~7チャネルにおいては,電位センサーとそれに接するポアドメインは異なるサブユニット由来,すなわちドメインが入れ替わった“domain swapped”チャネルであるのに対し,Kv10~12に含まれるEag, hERGなどはドメイン間の入れ替わりが起きない“non-domain swapped”チャネルである(図4).ちなみにクライオ電子顕微鏡によって解析し直されたKvAPは“non-domain swapped”チャネルであった96).今のところ,なぜ“domain swapped”チャネルと“non-domain swapped”チャネルが存在するのか,また二つの間の機能的な違いが何かについてはよくわかっていない.ただし,KVチャネルのことではないが,もともと“domain swapped”チャネルのTRPV6に点変異(L495Q)を導入することで“non-domain swapped”チャネルに変換することができたという興味深い報告がある97).
6. KVチャネル副サブユニットによる機能修飾と複合体形成
いくつかのKVチャネルには四量体構造を構成するαサブユニットの他に,βサブユニットなどと呼ばれる副サブユニットが存在する.たとえば最初に構造が解かれた哺乳類のKv1.2チャネルの結晶構造には,四つのβ2サブユニットが細胞質側に結合している69).また,β1サブユニットがKv1チャネルに結合すると,DrosophilaのShakerチャネルのように,N型の不活性化を起こすことも知られていた98, 99).
Kv4においても,細胞質タンパク質であるKChIP(KV channel-interacting protein)や,膜タンパク質のDPP6/10(dipeptidyl peptidase-related protein 6/10)といった副サブユニットが結合することにより,不活性化等の性質が大きく変化する100–102).これらの副サブユニットがどのようにKv4複合体を構成しているかについて,我々は一分子蛍光イメージングを用いた方法で解析し,それぞれのサブユニットの発現量に応じ,KChIPは1~4分子,DPP10は二量体構造をとりやすいことから2ないしは4分子が結合していることを報告した103, 104).しかしながら,これらのタンパク質がどのように不活性化の速度などを制御しているのかについてはよくわかっていなかった.その後のクライオ電子顕微鏡によるKv4.2–DPP6S–KChIP1複合体の構造解析により相互作用部位が明らかになり,副サブユニットによる機能修飾メカニズムの一端が明らかとなった91).KChIPについては,KChIPとKv4のN末端領域が相互作用していることは以前より報告があったが105),この新しい複合体構造により,KChIPとKv4のC末端領域との相互作用が機能的に重要であることが,変異体を用いた電気生理学的解析により示された.また,DPP6については,電位センサードメインのS1とS2の二つのセグメントに対して相互作用しており,この相互作用が不活性化制御に必要であることを,やはり変異体を用いた電気生理学的解析により示している91).
KCNQ1(KV7.1)チャネルは,副サブユニットによる修飾に関して非常に特徴的な性質を持っており,また心臓における不整脈に関わることから,KVチャネルファミリーの中では,ShakerやBKチャネルなどに次いで注目されてきた.もともとはQT延長症候群(long QT syndrome)の原因遺伝子として,ポジショナルクローニングにより同定されたKVチャネルであったため,当初はKVLQT1と呼ばれた106).しかしKVLQT1(KCNQ1)は単独では心臓で発現している遅いK+電流IKsを再現しなかった.minKと当時呼ばれていた1回膜貫通のタンパク質を共発現させることで,遅く活性化するIKs電流をアフリカツメガエル卵母細胞の発現系で再現できることがわかり,このminK(後にKCNE1と名づけられる)がKVLQT1(KCNQ1)チャネルの副サブユニットであることがわかった107, 108).ちなみにminKは,1988年に,当時京都大学の内匠,中西らによってクローニングされた全長130アミノ酸からなるタンパク質で,この遺伝子のcRNAをアフリカツメガエル卵母細胞に発現させると活性化の非常に遅いKV電流が観察されたため,当初はこのタンパク質自体がポアを構成し,遅いKV電流を担うと考えられた109).しかし,minKが単独で電流を生じた理由は,アフリカツメガエル卵母細胞の内在性KCNQ1チャネルと複合体を構成していたからであることが後に判明した110).
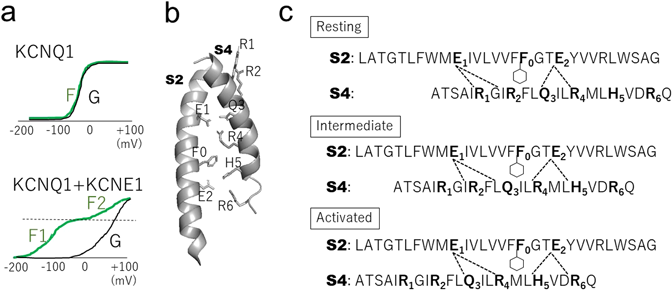
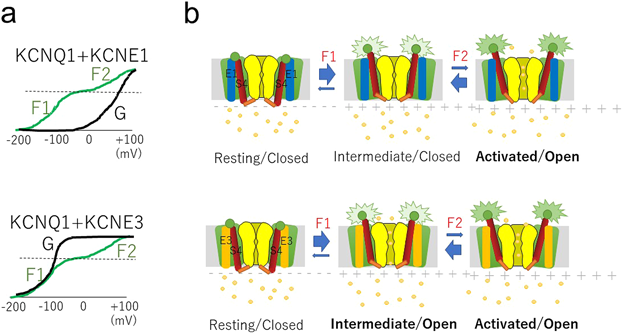
KCNQ1は最大4分子のKCNE1分子を結合することができる111–113).KCNE1には他にKCNE2~5まで5種類のメンバーが存在しており,いずれもKCNQ1と結合することで電流の性質を大きく変える114).とりわけ注目されているのが前述のKCNE1と,そしてKCNE3である.KCNE1はKCNQ1とともに心臓の遅いK+電流(IKs)を担い,そしてKCNQ1とともにQT延長症候群(IKsの減弱により心室筋の活動電位が延長するため起こる)の原因遺伝子であることから,生理学的に最も重要なKCNEといえる.一方,KCNE3は上皮細胞などでKCNQ1と複合体を形成し,電位依存的な開閉が失われた常時開状態のK+チャネルを構成する115).生理学的には小腸や気管支の上皮細胞において,K+のリサイクルをすることで間接的にCl−の輸送を助けていると考えられている116).このようにKCNQ1チャネルのゲーティングは,結合するKCNEの種類によって大きく変わることから,KCNEが電位センサードメインに何かしらの働きかけをしていると予想された.我々のグループとKobertzらのグループは,SCAM法をKCNQ1チャネルに適用し,電位センサーの動き(細胞外への露出度)がKCNE1あるいはKCNE3存在下で異なることを示した117, 118).また,KassとLarssonらは,VCFをKCNQ1に適用して,KCNQ1電位センサーの動きが,KCNE1,あるいはKCNE3存在下で大きく変化することを示した119–123).中でも興味深い発見は,KCNE1存在下において蛍光変化(F),すなわち電位センサーの電位依存性が,2段階(F1とF2)に完全にスプリットすることであった(図5a).KCNQ1の電位センサーは少なくとも三つの状態,Resting, Intermediate, Activatedをとることがわかっている(図5b, c).したがってKCNE1の作用は,単にS4を上がりにくくしているのではなく,S4の中間状態(Intermediate state)を安定化することであるとわかってきた121).同時期に我々もVCFを用い,KCNE1存在下ではS4とS5の両方に存在するフェニルアラニン残基同士の干渉が起き,S4がなかなかActivated stateに上がれなくなることがIKs電流におけるslow gatingのメカニズムであることを提唱した124).
実はその後のVCFにより,KCNE3においても電位センサーの動きが2段階にスプリットすることがわかった125, 126).それではなぜKCNQ1/KCNE1(遅く活性化するチャネル)とKCNQ1/KCNE3(常時開状態チャネル)のそれぞれで性質が大きく異なるかについてであるが,現在では以下のように考えられている.両者の一番大きな違いは,中間状態でのポアの状態にある.KCNE1の存在下においては中間状態での電流は抑制され(Intermediate/Closed),S4がさらに上昇してActivated stateに入らなければ電流が流れない.つまり,KCNE1存在下では,チャネルが開くためにはすべての電位センサーがActivated stateに入る必要があるため,KCNE1では電流の活性化が見かけ上遅くなる.一方,KCNE3存在下の場合は中間状態でも電流が流れるため(Intermediate/Open),生理的な膜電位の範囲では常に開状態になる(図6)122).
2020年にMacKinnonらはKCNQ1–KCNE3–calmodulin (CaM)複合体構造を発表した85).これにより,KCNE3はKCNQ1のS1セグメントの隣に位置していることがはっきりとわかったため,我々はKCNE3とS1セグメント間の相互作用が,電位センサードメインの動き,特に中間状態を安定化する際に必要であるという仮説を立て,両者の相互作用部位にシステマティックに変異を導入した.すると,相互作用部位のほとんどにおいて,アミノ酸側鎖を大きくしても小さくしても中間状態が不安定になり,KCNQ1–KCNE3チャネルが閉じやすく変化することを見いだした.このことから,KCNE3とS1の相互作用はかなりよく最適化されており,KCNE3がS1セグメントを介してS4セグメントを制御していると結論づけた126).
KVチャネルに限らず,多くの膜タンパク質の構造がクライオ電子顕微鏡により次々と明らかにされている.そして2021年にセンセーショナルに登場したAlphaFold2により,まだ解かれていない構造であっても,ある程度手軽に構造予測ができるようになってきた127).したがって,ほとんどのKVチャネルを含むイオンチャネルの構造は,早晩すべて出そろうであろう.しかしながら,これまで明らかになっているKVチャネルの構造はすべて膜電位がかかっていない,つまり0 mVの構造である.そしてKVチャネルは0 mVのときに安定な状態,すなわちS4セグメントが上がった開状態(KVチャネルの種類によっては不活性化状態)に入っていると考えられる.閉状態を作り出すには,チャネルの細胞外側から細胞内側にかけて電位差を作る必要がある.技術的には困難であるが,システイン残基同士をMTS-1-MTSのようなクロスリンカーで架橋し,閉状態様構造を得る試みや95),リポソームに埋め込み,K+の濃度勾配で電位差を作って構造解析を行う試みやなども行われている128).閉状態,中間状態から開状態,さらには不活性化状態の構造を得ることで,ゲーティングサイクルをコンプリートすることが,今後の課題である.
複合体構造に関しては,KCNQ1–KCNE3–CaM85)やKv4.2–DPP6S–KChIP191),Slo1-β4129)などいくつかの例が報告されてはいるものの,まだ少数である.複合体構造が得られただけでは必ずしも機能修飾機構を理解することはできないが,点変異体などの機能解析を行うにあたり,大きな手がかりとなる.今後複合体の構造がさらに増えてきて,副サブユニットによる機能修飾機構の理解が深まることが期待される.
KVチャネルは神経細胞,筋細胞などの興奮性細胞はもちろんのこと,気管,消化管,腎臓や内分泌器官など,実にさまざまな臓器で働いており,てんかん,不整脈,難聴,腎臓病や糖尿病などさまざまな疾患との関連が報告されている.したがって,これらのいわゆる“チャネル病”に対処するためには,より特異的な活性化剤,抑制剤の開発が求められている.これまでにKCNQ4チャネルに活性化剤のretigabineや抑制剤のlinopirdineが結合した構造,hERGチャネルにブロッカー(astemizole)が結合した構造などが報告されている90, 92, 94, 130).また最近ではKv1.3チャネルに特異的に結合し抑制するナノボディ抗体についても報告があった131).今後ますますこのような報告が増えることが期待される一方で,これまでに得られた構造情報をもとに,既存のあるいは未知の化合物がどのようにイオンチャネルに結合するのかを,結合シミュレーションなどを用いて明らかにすることも進めやすくなり,今後のイオンチャネル創薬のさらなる発展が期待される.
また,上記の疾患に対処するためにも,KVチャネルがどこで(細胞内局在),どのような形で(複合体構成)機能するかを知ることが重要となってくるが,そういった情報は,一部を除いてまだ乏しい.発現,あるいは精製した状態でのKVチャネルの機能,構造はずいぶんと理解が進んだ.今後は生体内でどのような構造,複合体構成,機能を持つかを知る段階に進んでいくと思われる.
謝辞Acknowledgments
本稿を作成するにあたって,自治医科大学統合生理学部門の糟谷豪博士と善方文太郎博士,大学院生の劉嘉瑩さんから助言いただきました.感謝いたします.
引用文献References
1) Hodgkin, A.L. & Huxley, A.F. (1952) A quantitative description of membrane current and its application to conduction and excitation in nerve. J. Physiol., 117, 500–544.
2) Hodgkin, A.L., Huxley, A.F., & Katz, B. (1952) Measurement of current-voltage relations in the membrane of the giant axon of Loligo. J. Physiol., 116, 424–448.
3) Hodgkin, A.L. & Huxley, A.F. (1952) Currents carried by sodium and potassium ions through the membrane of the giant axon of Loligo. J. Physiol., 116, 449–472.
4) Hodgkin, A.L. & Huxley, A.F. (1952) The components of membrane conductance in the giant axon of Loligo. J. Physiol., 116, 473–496.
5) Hodgkin, A.L. & Huxley, A.F. (1952) The dual effect of membrane potential on sodium conductance in the giant axon of Loligo. J. Physiol., 116, 497–506.
6) Chen, L.Q., Santarelli, V., Horn, R., & Kallen, R.G. (1996) A unique role for the S4 segment of domain 4 in the inactivation of sodium channels. J. Gen. Physiol., 108, 549–556.
7) Chanda, B. & Bezanilla, F. (2002) Tracking voltage-dependent conformational changes in skeletal muscle sodium channel during activation. J. Gen. Physiol., 120, 629–645.
8) Capes, D.L., Goldschen-Ohm, M.P., Arcisio-Miranda, M., Bezanilla, F., & Chanda, B. (2013) Domain IV voltage-sensor movement is both sufficient and rate limiting for fast inactivation in sodium channels. J. Gen. Physiol., 142, 101–112.
9) Brake, N., Mancino, A.S., Yan, Y., Shimomura, T., Kubo, Y., Khadra, A., & Bowie, D. (2022) Closed-state inactivation of cardiac, skeletal, and neuronal sodium channels is isoform specific. J. Gen. Physiol., 154, e202112921.
10) Neher, E. & Sakmann, B. (1976) Single-channel currents recorded from membrane of denervated frog muscle fibres. Nature, 260, 799–802.
11) Noda, M., Shimizu, S., Tanabe, T., Takai, T., Kayano, T., Ikeda, T., Takahashi, H., Nakayama, H., Kanaoka, Y., Minamino, N., et al. (1984) Primary structure of Electrophorus electricus sodium channel deduced from cDNA sequence. Nature, 312, 121–127.
12) Noda, M., Takahashi, H., Tanabe, T., Toyosato, M., Furutani, Y., Hirose, T., Asai, M., Inayama, S., Miyata, T., & Numa, S. (1982) Primary structure of alpha-subunit precursor of Torpedo californica acetylcholine receptor deduced from cDNA sequence. Nature, 299, 793–797.
13) Noda, M., Takahashi, H., Tanabe, T., Toyosato, M., Kikyotani, S., Hirose, T., Asai, M., Takashima, H., Inayama, S., Miyata, T., et al. (1983) Primary structures of beta- and delta-subunit precursors of Torpedo californica acetylcholine receptor deduced from cDNA sequences. Nature, 301, 251–255.
14) Salkoff, L. & Wyman, R. (1981) Genetic modification of potassium channels in Drosophila Shaker mutants. Nature, 293, 228–230.
15) Papazian, D.M., Schwarz, T.L., Tempel, B.L., Jan, Y.N., & Jan, L.Y. (1987) Cloning of genomic and complementary DNA from Shaker, a putative potassium channel gene from Drosophila. Science, 237, 749–753.
16) Tempel, B.L., Papazian, D.M., Schwarz, T.L., Jan, Y.N., & Jan, L.Y. (1987) Sequence of a probable potassium channel component encoded at Shaker locus of Drosophila. Science, 237, 770–775.
17) Kamb, A., Iverson, L.E., & Tanouye, M.A. (1987) Molecular characterization of Shaker, a Drosophila gene that encodes a potassium channel. Cell, 50, 405–413.
18) Nimigean, C.M. (2022) 35 years of channelling potassium ions. Nature, 608, 670–672.
19) Timpe, L.C., Schwarz, T.L., Tempel, B.L., Papazian, D.M., Jan, Y.N., & Jan, L.Y. (1988) Expression of functional potassium channels from Shaker cDNA in Xenopus oocytes. Nature, 331, 143–145.
20) Nimigean, C.M. (2022) 35 years of channelling potassium ions. Nature, 608, 670–672. doi: 10.1038/d41586-022-02163-3.
21) Papazian, D.M., Timpe, L.C., Jan, Y.N., & Jan, L.Y. (1991) Alteration of voltage-dependence of Shaker potassium channel by mutations in the S4 sequence. Nature, 349, 305–310.
22) Christie, M.J., Adelman, J.P., Douglass, J., & North, R.A. (1989) Expression of a cloned rat brain potassium channel in Xenopus oocytes. Science, 244, 221–224.
23) Chandy, K.G., Williams, C.B., Spencer, R.H., Aguilar, B.A., Ghanshani, S., Tempel, B.L., & Gutman, G.A. (1990) A family of three mouse potassium channel genes with intronless coding regions. Science, 247, 973–975.
24) Ramaswami, M., Gautam, M., Kamb, A., Rudy, B., Tanouye, M.A., & Mathew, M.K. (1990) Human potassium channel genes: Molecular cloning and functional expression. Mol. Cell. Neurosci., 1, 214–223.
25) Ranjan, R., Logette, E., Marani, M., Herzog, M., Tâche, V., Scantamburlo, E., Buchillier, V., & Markram, H. (2019) A kinetic map of the homomeric voltage-gated potassium channel (Kv) family. Front. Cell. Neurosci., 13, 358.
26) Atkinson, N.S., Robertson, G.A., & Ganetzky, B. (1991) A component of calcium-activated potassium channels encoded by the Drosophila slo locus. Science, 253, 551–555.
27) Ho, K., Nichols, C.G., Lederer, W.J., Lytton, J., Vassilev, P.M., Kanazirska, M.V., & Hebert, S.C. (1993) Cloning and expression of an inwardly rectifying ATP-regulated potassium channel. Nature, 362, 31–38.
28) Kubo, Y., Baldwin, T.J., Jan, Y.N., & Jan, L.Y. (1993) Primary structure and functional expression of a mouse inward rectifier potassium channel. Nature, 362, 127–133.
29) Kubo, Y., Reuveny, E., Slesinger, P.A., Jan, Y.N., & Jan, L.Y. (1993) Primary structure and functional expression of a rat G-protein-coupled muscarinic potassium channel. Nature, 364, 802–806.
30) Matsuda, H., Saigusa, A., & Irisawa, H. (1987) Ohmic conductance through the inwardly rectifying K channel and blocking by internal Mg2+. Nature, 325, 156–159.
31) Fakler, B., Brändle, U., Glowatzki, E., Weidemann, S., Zenner, H.P., & Ruppersberg, J.P. (1995) Strong voltage-dependent inward rectification of inward rectifier K+ channels is caused by intracellular spermine. Cell, 80, 149–154.
32) Lesage, F., Guillemare, E., Fink, M., Duprat, F., Lazdunski, M., Romey, G., & Barhanin, J. (1996) TWIK-1, a ubiquitous human weakly inward rectifying K+ channel with a novel structure. EMBO J., 15, 1004–1011.
33) Murata, Y., Iwasaki, H., Sasaki, M., Inaba, K., & Okamura, Y. (2005) Phosphoinositide phosphatase activity coupled to an intrinsic voltage sensor. Nature, 435, 1239–1243.
34) Sasaki, M., Takagi, M., & Okamura, Y. (2006) A voltage sensor-domain protein is a voltage-gated proton channel. Science, 312, 589–592.
35) Ramsey, I.S., Moran, M.M., Chong, J.A., & Clapham, D.E. (2006) A voltage-gated proton-selective channel lacking the pore domain. Nature, 440, 1213–1216.
36) Tanabe, T., Takeshima, H., Mikami, A., Flockerzi, V., Takahashi, H., Kangawa, K., Kojima, M., Matsuo, H., Hirose, T., & Numa, S. (1987) Primary structure of the receptor for calcium channel blockers from skeletal muscle. Nature, 328, 313–318.
37) Christie, M.J., North, R.A., Osborne, P.B., Douglass, J., & Adelman, J.P. (1990) Heteropolymeric potassium channels expressed in Xenopus oocytes from cloned subunits. Neuron, 4, 405–411.
38) Isacoff, E.Y., Jan, Y.N., & Jan, L.Y. (1990) Evidence for the formation of heteromultimeric potassium channels in Xenopus oocytes. Nature, 345, 530–534.
39) Ruppersberg, J.P., Schröter, K.H., Sakmann, B., Stocker, M., Sewing, S., & Pongs, O. (1990) Heteromultimeric channels formed by rat brain potassium-channel proteins. Nature, 345, 535–537.
40) Hoshi, T., Zagotta, W.N., & Aldrich, R.W. (1990) Biophysical and molecular mechanisms of Shaker potassium channel inactivation. Science, 250, 533–538.
41) Zagotta, W.N., Hoshi, T., & Aldrich, R.W. (1990) Restoration of inactivation in mutants of Shaker potassium channels by a peptide derived from ShB. Science, 250, 568–571.
42) Hoshi, T., Zagotta, W.N., & Aldrich, R.W. (1994) Shaker potassium channel gating. I: Transitions near the open state. J. Gen. Physiol., 103, 249–278.
43) Zagotta, W.N., Hoshi, T., Dittman, J., & Aldrich, R.W. (1994) Shaker potassium channel gating. II: Transitions in the activation pathway. J. Gen. Physiol., 103, 279–319.
44) Zagotta, W.N., Hoshi, T., & Aldrich, R.W. (1994) Shaker potassium channel gating. III: Evaluation of kinetic models for activation. J. Gen. Physiol., 103, 321–362.
45) Smith-Maxwell, C.J., Ledwell, J.L., & Aldrich, R.W. (1998) Uncharged S4 residues and cooperativity in voltage-dependent potassium channel activation. J. Gen. Physiol., 111, 421–439.
46) Armstrong, C.M. & Bezanilla, F. (1973) Currents related to movement of the gating particles of the sodium channels. Nature, 242, 459–461.
47) Bezanilla, F. & Armstrong, C.M. (1974) Gating currents of the sodium channels: Three ways to block them. Science, 183, 753–754.
48) Armstrong, C.M. & Bezanilla, F. (1974) Charge movement associated with the opening and closing of the activation gates of the Na channels. J. Gen. Physiol., 63, 533–552.
49) Keynes, R.D. & Rojas, E. (1974) Kinetics and steady-state properties of the charged system controlling sodium conductance in the squid giant axon. J. Physiol., 239, 393–434.
50) Bezanilla, F., Perozo, E., Papazian, D.M., & Stefani, E. (1991) Molecular basis of gating charge immobilization in Shaker potassium channels. Science, 254, 679–683.
51) Schoppa, N.E., McCormack, K., Tanouye, M.A., & Sigworth, F.J. (1992) The size of gating charge in wild-type and mutant Shaker potassium channels. Science, 255, 1712–1715.
52) Akabas, M.H., Stauffer, D.A., Xu, M., & Karlin, A. (1992) Acetylcholine receptor channel structure probed in cysteine-substitution mutants. Science, 258, 307–310.
53) Yang, N., George, A.L. Jr., & Horn, R. (1996) Molecular basis of charge movement in voltage-gated sodium channels. Neuron, 16, 113–122.
54) Larsson, H.P., Baker, O.S., Dhillon, D.S., & Isacoff, E.Y. (1996) Transmembrane movement of the shaker K+ channel S4. Neuron, 16, 387–397.
55) Mannuzzu, L.M., Moronne, M.M., & Isacoff, E.Y. (1996) Direct physical measure of conformational rearrangement underlying potassium channel gating. Science, 271, 213–216.
56) Zheng, J. & Zagotta, W.N. (2000) Gating rearrangements in cyclic nucleotide-gated channels revealed by patch-clamp fluorometry. Neuron, 28, 369–374.
57) Kalstrup, T. & Blunck, R. (2013) Dynamics of internal pore opening in K(V) channels probed by a fluorescent unnatural amino acid. Proc. Natl. Acad. Sci. USA, 110, 8272–8277.
58) Sakata, S., Jinno, Y., Kawanabe, A., & Okamura, Y. (2016) Voltage-dependent motion of the catalytic region of voltage-sensing phosphatase monitored by a fluorescent amino acid. Proc. Natl. Acad. Sci. USA, 113, 7521–7526.
59) Andriani, R.T. & Kubo, Y. (2021) Voltage-clamp fluorometry analysis of structural rearrangements of ATP-gated channel P2X2 upon hyperpolarization. eLife, 10, e65822.
60) Cha, A., Snyder, G.E., Selvin, P.R., & Bezanilla, F. (1999) Atomic scale movement of the voltage-sensing region in a potassium channel measured via spectroscopy. Nature, 402, 809–813.
61) Doyle, D.A., Morais Cabral, J., Pfuetzner, R.A., Kuo, A., Gulbis, J.M., Cohen, S.L., Chait, B.T., & MacKinnon, R. (1998) The structure of the potassium channel: Molecular basis of K+ conduction and selectivity. Science, 280, 69–77.
62) Cuello, L.G., Romero, J.G., Cortes, D.M., & Perozo, E. (1998) pH-dependent gating in the Streptomyces lividans K+ channel. Biochemistry, 37, 3229–3236.
63) Heginbotham, L., Lu, Z., Abramson, T., & MacKinnon, R. (1994) Mutations in the K+ channel signature sequence. Biophys. J., 66, 1061–1067.
64) Zhou, Y., Morais-Cabral, J.H., Kaufman, A., & MacKinnon, R. (2001) Chemistry of ion coordination and hydration revealed by a K+ channel-Fab complex at 2.0 A resolution. Nature, 414, 43–48.
65) Jiang, Y., Lee, A., Chen, J., Cadene, M., Chait, B.T., & MacKinnon, R. (2002) Crystal structure and mechanism of a calcium-gated potassium channel. Nature, 417, 515–522.
66) Jiang, Y., Lee, A., Chen, J., Cadene, M., Chait, B.T., & MacKinnon, R. (2002) The open pore conformation of potassium channels. Nature, 417, 523–526.
67) Jiang, Y., Lee, A., Chen, J., Ruta, V., Cadene, M., Chait, B.T., & MacKinnon, R. (2003) X-ray structure of a voltage-dependent K+ channel. Nature, 423, 33–41.
68) Jiang, Y., Ruta, V., Chen, J., Lee, A., & MacKinnon, R. (2003) The principle of gating charge movement in a voltage-dependent K+ channel. Nature, 423, 42–48.
69) Long, S.B., Campbell, E.B., & Mackinnon, R. (2005) Crystal structure of a mammalian voltage-dependent Shaker family K+ channel. Science, 309, 897–903.
70) Long, S.B., Campbell, E.B., & Mackinnon, R. (2005) Voltage sensor of Kv1.2: Structural basis of electromechanical coupling. Science, 309, 903–908.
71) Long, S.B., Tao, X., Campbell, E.B., & MacKinnon, R. (2007) Atomic structure of a voltage-dependent K+ channel in a lipid membrane-like environment. Nature, 450, 376–382.
72) Tao, X., Lee, A., Limapichat, W., Dougherty, D.A., & MacKinnon, R. (2010) A gating charge transfer center in voltage sensors. Science, 328, 67–73.
73) Yarov-Yarovoy, V., Baker, D., & Catterall, W.A. (2006) Voltage sensor conformations in the open and closed states in ROSETTA structural models of K(+) channels. Proc. Natl. Acad. Sci. USA, 103, 7292–7297.
74) Campos, F.V., Chanda, B., Roux, B., & Bezanilla, F. (2007) Two atomic constraints unambiguously position the S4 segment relative to S1 and S2 segments in the closed state of Shaker K channel. Proc. Natl. Acad. Sci. USA, 104, 7904–7909.
75) Shaw, D.E., Deneroff, M.M., Dror, R.O., Kuskin, J.S., Larson, R.H., Salmon, J.K., Young, C., Batson, B., Bowers, K.J., Chao, J.C., et al. (2008) Anton, a special-purpose machine for molecular dynamics simulation. Commun. ACM, 51, 91–97.
76) Jensen, M.Ø., Jogini, V., Borhani, D.W., Leffler, A.E., Dror, R.O., & Shaw, D.E. (2012) Mechanism of voltage gating in potassium channels. Science, 336, 229–233.
77) Liao, M., Cao, E., Julius, D., & Cheng, Y. (2013) Structure of the TRPV1 ion channel determined by electron cryo-microscopy. Nature, 504, 107–112.
78) Cao, E., Liao, M., Cheng, Y., & Julius, D. (2013) TRPV1 structures in distinct conformations reveal activation mechanisms. Nature, 504, 113–118.
79) Sato, C., Ueno, Y., Asai, K., Takahashi, K., Sato, M., Engel, A., & Fujiyoshi, Y. (2001) The voltage-sensitive sodium channel is a bell-shaped molecule with several cavities. Nature, 409, 1047–1051.
80) Caterina, M.J., Rosen, T.A., Tominaga, M., Brake, A.J., & Julius, D. (1999) A capsaicin-receptor homologue with a high threshold for noxious heat. Nature, 398, 436–441.
81) Coste, B., Mathur, J., Schmidt, M., Earley, T.J., Ranade, S., Petrus, M.J., Dubin, A.E., & Patapoutian, A. (2010) Piezo1 and Piezo2 are essential components of distinct mechanically activated cation channels. Science, 330, 55–60.
82) Whicher, J.R. & MacKinnon, R. (2016) Structure of the voltage-gated K+ channel Eag1 reveals an alternative voltage sensing mechanism. Science, 353, 664–669.
83) Wang, W. & MacKinnon, R. (2017) Cryo-EM structure of the open human ether-à-go-go-related K+ channel hERG. Cell, 169, 422–430.e10.
84) Sun, J. & MacKinnon, R. (2017) Cryo-EM structure of a KCNQ1/CaM complex reveals insights into congenital long QT syndrome. Cell, 169, 1042–1050.e9.
85) Sun, J. & MacKinnon, R. (2020) Structural basis of human KCNQ1 modulation and gating. Cell, 180, 340–347.e9.
86) Tao, X., Hite, R.K., & MacKinnon, R. (2017) Cryo-EM structure of the open high-conductance Ca2+-activated K+ channel. Nature, 541, 46–51.
87) Hite, R.K., Tao, X., & MacKinnon, R. (2017) Structural basis for gating the high-conductance Ca2+-activated K+ channel. Nature, 541, 52–57.
88) Hite, R.K., Yuan, P., Li, Z., Hsuing, Y., Walz, T., & MacKinnon, R. (2015) Cryo-electron microscopy structure of the Slo2.2 Na(+)-activated K(+) channel. Nature, 527, 198–203.
89) Hite, R.K. & MacKinnon, R. (2017) Structural titration of Slo2.2, a Na+-dependent K+ channel. Cell, 168, 390–399.e11.
90) Li, T., Wu, K., Yue, Z., Wang, Y., Zhang, F., & Shen, H. (2021) Structural basis for the modulation of human KCNQ4 by small-molecule drugs. Mol. Cell, 81, 25–37.e4. doi: 10.1016/j.molcel.2020.10.037.
91) Kise, Y., Kasuya, G., Okamoto, H.H., Yamanouchi, D., Kobayashi, K., Kusakizako, T., Nishizawa, T., Nakajo, K., & Nureki, O. (2021) Structural basis of gating modulation of Kv4 channel complexes. Nature, 599, 158–164.
92) Li, X., Zhang, Q., Guo, P., Fu, J., Mei, L., Lv, D., Wang, J., Lai, D., Ye, S., Yang, H., et al. (2021) Molecular basis for ligand activation of the human KCNQ2 channel. Cell Res., 31, 52–61.
93) Chi, G., Liang, Q., Sridhar, A., Cowgill, J.B., Sader, K., Radjainia, M., Qian, P., Castro-Hartmann, P., Venkaya, S., Singh, N.K., et al. (2022) Cryo-EM structure of the human Kv3.1 channel reveals gating control by the cytoplasmic T1 domain. Nat. Commun., 13, 4087.
94) Zheng, Y., Liu, H., Chen, Y., Dong, S., Wang, F., Wang, S., Li, G.L., Shu, Y., & Xu, F. (2022) Structural insights into the lipid and ligand regulation of a human neuronal KCNQ channel. Neuron, 110, 237–247.e4.
95) Ye, W., Zhao, H., Dai, Y., Wang, Y., Lo, Y.H., Jan, L.Y., & Lee, C.H. (2022) Activation and closed-state inactivation mechanisms of the human voltage-gated KV4 channel complexes. Mol. Cell, 82, 2427–2442.e4. doi: 10.1016/j.molcel.2022.04.032.
96) Tao, X. & MacKinnon, R. (2019) Cryo-EM structure of the KvAP channel reveals a non-domain-swapped voltage sensor topology. eLife, 8, e52164.
97) Singh, A.K., Saotome, K., & Sobolevsky, A.I. (2017) Swapping of transmembrane domains in the epithelial calcium channel TRPV6. Sci. Rep., 7, 10669.
98) Rettig, J., Heinemann, S.H., Wunder, F., Lorra, C., Parcej, D.N., Dolly, J.O., & Pongs, O. (1994) Inactivation properties of voltage-gated K+ channels altered by presence of beta-subunit. Nature, 369, 289–294.
99) Zhou, M., Morais-Cabral, J.H., Mann, S., & MacKinnon, R. (2001) Potassium channel receptor site for the inactivation gate and quaternary amine inhibitors. Nature, 411, 657–661.
100) An, W.F., Bowlby, M.R., Betty, M., Cao, J., Ling, H.P., Mendoza, G., Hinson, J.W., Mattsson, K.I., Strassle, B.W., Trimmer, J.S., et al. (2000) Modulation of A-type potassium channels by a family of calcium sensors. Nature, 403, 553–556.
101) Nadal, M.S., Ozaita, A., Amarillo, Y., Vega-Saenz de Miera, E., Ma, Y., Mo, W., Goldberg, E.M., Misumi, Y., Ikehara, Y., Neubert, T.A., et al. (2003) The CD26-related dipeptidyl aminopeptidase-like protein DPPX is a critical component of neuronal A-type K+ channels. Neuron, 37, 449–461.
102) Zagha, E., Ozaita, A., Chang, S.Y., Nadal, M.S., Lin, U., Saganich, M.J., McCormack, T., Akinsanya, K.O., Qi, S.Y., & Rudy, B. (2005) DPP10 modulates Kv4-mediated A-type potassium channels. J. Biol. Chem., 280, 18853–18861.
103) Kitazawa, M., Kubo, Y., & Nakajo, K. (2014) The stoichiometry and biophysical properties of the Kv4 potassium channel complex with K+ channel-interacting protein (KChIP) subunits are variable, depending on the relative expression level. J. Biol. Chem., 289, 17597–17609.
104) Kitazawa, M., Kubo, Y., & Nakajo, K. (2015) Kv4.2 and accessory dipeptidyl peptidase-like protein 10 (DPP10) subunit preferentially form a 4:2 (Kv4.2:DPP10) channel complex. J. Biol. Chem., 290, 22724–22733.
105) Pioletti, M., Findeisen, F., Hura, G.L., & Minor, D.L. Jr. (2006) Three-dimensional structure of the KChIP1-Kv4.3 T1 complex reveals a cross-shaped octamer. Nat. Struct. Mol. Biol., 13, 987–995.
106) Wang, Q., Curran, M.E., Splawski, I., Burn, T.C., Millholland, J.M., VanRaay, T.J., Shen, J., Timothy, K.W., Vincent, G.M., de Jager, T., et al. (1996) Positional cloning of a novel potassium channel gene: KVLQT1 mutations cause cardiac arrhythmias. Nat. Genet., 12, 17–23.
107) Barhanin, J., Lesage, F., Guillemare, E., Fink, M., Lazdunski, M., & Romey, G. (1996) K(V)LQT1 and lsK (minK) proteins associate to form the I(Ks) cardiac potassium current. Nature, 384, 78–80.
108) Sanguinetti, M.C., Curran, M.E., Zou, A., Shen, J., Spector, P.S., Atkinson, D.L., & Keating, M.T. (1996) Coassembly of K(V)LQT1 and minK (IsK) proteins to form cardiac I(Ks) potassium channel. Nature, 384, 80–83.
109) Takumi, T., Ohkubo, H., & Nakanishi, S. (1988) Cloning of a membrane protein that induces a slow voltage-gated potassium current. Science, 242, 1042–1045.
110) Tzounopoulos, T., Maylie, J., & Adelman, J.P. (1998) Gating of I(sK) channels expressed in Xenopus oocytes. Biophys. J., 74, 2299–2305.
111) Nakajo, K., Ulbrich, M.H., Kubo, Y., & Isacoff, E.Y. (2010) Stoichiometry of the KCNQ1-KCNE1 ion channel complex. Proc. Natl. Acad. Sci. USA, 107, 18862–18867.
112) Yu, H., Lin, Z., Mattmann, M.E., Zou, B., Terrenoire, C., Zhang, H., Wu, M., McManus, O.B., Kass, R.S., Lindsley, C.W., et al. (2013) Dynamic subunit stoichiometry confers a progressive continuum of pharmacological sensitivity by KCNQ potassium channels. Proc. Natl. Acad. Sci. USA, 110, 8732–8737.
113) Murray, C.I., Westhoff, M., Eldstrom, J., Thompson, E., Emes, R., & Fedida, D. (2016) Unnatural amino acid photo-crosslinking of the IKs channel complex demonstrates a KCNE1:KCNQ1 stoichiometry of up to 4:4. eLife, 5, e11815.
114) Lundquist, A.L., Manderfield, L.J., Vanoye, C.G., Rogers, C.S., Donahue, B.S., Chang, P.A., Drinkwater, D.C., Murray, K.T., & George, A.L. Jr. (2005) Expression of multiple KCNE genes in human heart may enable variable modulation of I(Ks). J. Mol. Cell. Cardiol., 38, 277–287.
115) Schroeder, B.C., Waldegger, S., Fehr, S., Bleich, M., Warth, R., Greger, R., & Jentsch, T.J. (2000) A constitutively open potassium channel formed by KCNQ1 and KCNE3. Nature, 403, 196–199.
116) Preston, P., Wartosch, L., Günzel, D., Fromm, M., Kongsuphol, P., Ousingsawat, J., Kunzelmann, K., Barhanin, J., Warth, R., & Jentsch, T.J. (2010) Disruption of the K+ channel beta-subunit KCNE3 reveals an important role in intestinal and tracheal Cl− transport. J. Biol. Chem., 285, 7165–7175.
117) Nakajo, K. & Kubo, Y. (2007) KCNE1 and KCNE3 stabilize and/or slow voltage sensing S4 segment of KCNQ1 channel. J. Gen. Physiol., 130, 269–281.
118) Rocheleau, J.M. & Kobertz, W.R. (2008) KCNE peptides differently affect voltage sensor equilibrium and equilibration rates in KCNQ1 K+ channels. J. Gen. Physiol., 131, 59–68.
119) Osteen, J.D., Gonzalez, C., Sampson, K.J., Iyer, V., Rebolledo, S., Larsson, H.P., & Kass, R.S. (2010) KCNE1 alters the voltage sensor movements necessary to open the KCNQ1 channel gate. Proc. Natl. Acad. Sci. USA, 107, 22710–22715.
120) Osteen, J.D., Barro-Soria, R., Robey, S., Sampson, K.J., Kass, R.S., & Larsson, H.P. (2012) Allosteric gating mechanism underlies the flexible gating of KCNQ1 potassium channels. Proc. Natl. Acad. Sci. USA, 109, 7103–7108.
121) Barro-Soria, R., Rebolledo, S., Liin, S.I., Perez, M.E., Sampson, K.J., Kass, R.S., & Larsson, H.P. (2014) KCNE1 divides the voltage sensor movement in KCNQ1/KCNE1 channels into two steps. Nat. Commun., 5, 3750.
122) Barro-Soria, R., Perez, M.E., & Larsson, H.P. (2015) KCNE3 acts by promoting voltage sensor activation in KCNQ1. Proc. Natl. Acad. Sci. USA, 112, E7286–E7292.
123) Barro-Soria, R., Ramentol, R., Liin, S.I., Perez, M.E., Kass, R.S., & Larsson, H.P. (2017) KCNE1 and KCNE3 modulate KCNQ1 channels by affecting different gating transitions. Proc. Natl. Acad. Sci. USA, 114, E7367–E7376.
124) Nakajo, K. & Kubo, Y. (2014) Steric hindrance between S4 and S5 of the KCNQ1/KCNE1 channel hampers pore opening. Nat. Commun., 5, 4100.
125) Taylor, K.C., Kang, P.W., Hou, P., Yang, N.D., Kuenze, G., Smith, J.A., Shi, J., Huang, H., White, K.M., Peng, D., et al. (2020) Structure and physiological function of the human KCNQ1 channel voltage sensor intermediate state. eLife, 9, e53901.
126) Kasuya, G. & Nakajo, K. (2022) Optimized tight binding between the S1 segment and KCNE3 is required for the constitutively open nature of the KCNQ1–KCNE3 channel complex. eLife, 11, e81683.
127) Jumper, J., Evans, R., Pritzel, A., Green, T., Figurnov, M., Ronneberger, O., Tunyasuvunakool, K., Bates, R., Žídek, A., Potapenko, A., et al. (2021) Highly accurate protein structure prediction with AlphaFold. Nature, 596, 583–589.
128) Mandala, V.S. & MacKinnon, R. (2022) Voltage-sensor movements in the Eag Kv channel under an applied electric field. Proc. Natl. Acad. Sci. USA, 119, e2214151119.
129) Tao, X. & MacKinnon, R. (2019) Molecular structures of the human Slo1 K+ channel in complex with β4. eLife, 8, e51409.
130) Asai, T., Adachi, N., Moriya, T., Oki, H., Maru, T., Kawasaki, M., Suzuki, K., Chen, S., Ishii, R., Yonemori, K., et al. (2021) Cryo-EM structure of K+-bound hERG channel complexed with the blocker astemizole. Structure, 29, 203–212.e4.
131) Selvakumar, P., Fernández-Mariño, A.I., Khanra, N., He, C., Paquette, A.J., Wang, B., Huang, R., Smider, V.V., Rice, W.J., Swartz, K.J., et al. (2022) Structures of the T cell potassium channel Kv1.3 with immunoglobulin modulators. Nat. Commun., 13, 3854.
132) Yu, F.H. & Catterall, W.A. (2004) The VGL-chanome: A protein superfamily specialized for electrical signaling and ionic homeostasis. Sci. STKE, 2004, re15.
著者紹介Author Profile
 中條 浩一(なかじょう こういち)
中條 浩一(なかじょう こういち)自治医科大学医学部生理学講座統合生理学部門 教授.博士(学術).
略歴1973年京都府生まれ.97年東京大学教養学部基礎科学科第一卒業.2002年同大学院総合文化研究科博士課程修了.05年生理学研究所助手(のち助教).15年大阪医科大学医学部准教授.18年より現職.
研究テーマと抱負イオンチャネルの構造機能連関.特に修飾サブユニットによるイオンチャネルの機能修飾メカニズム.イオンチャネルの性質や機能が,生体内での生理機能にどのように役立つかを明らかにしたい.
ウェブサイトhttp://www. www.jichi.ac.jp/physio2/index.html
趣味スポーツ観戦(野球,アメフト,バスケ),ウイスキー.