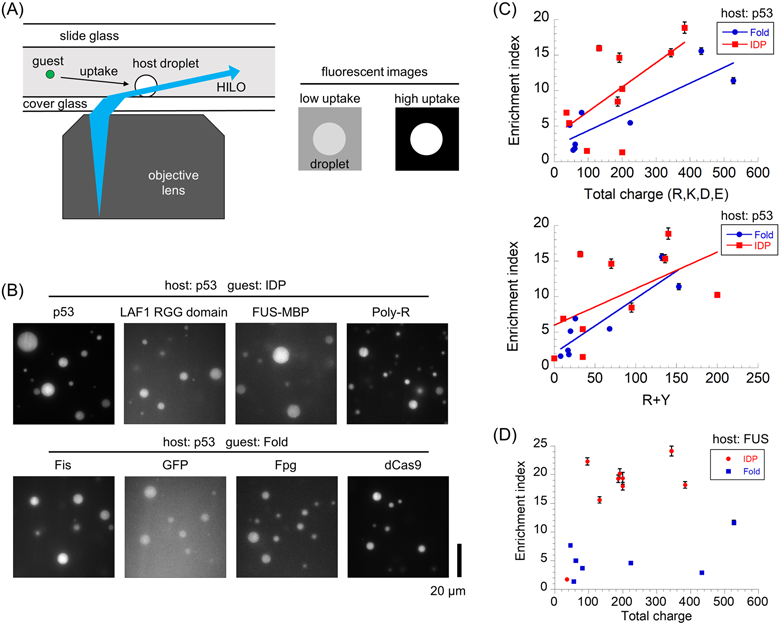
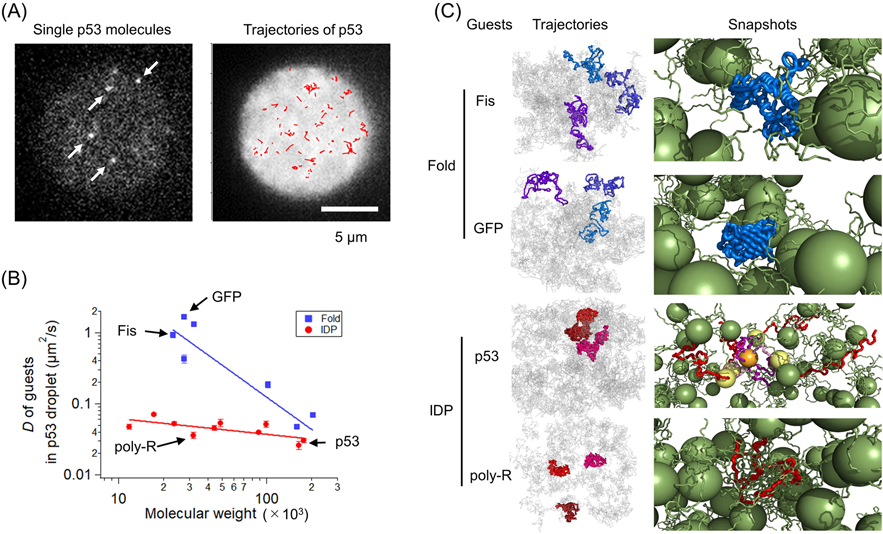
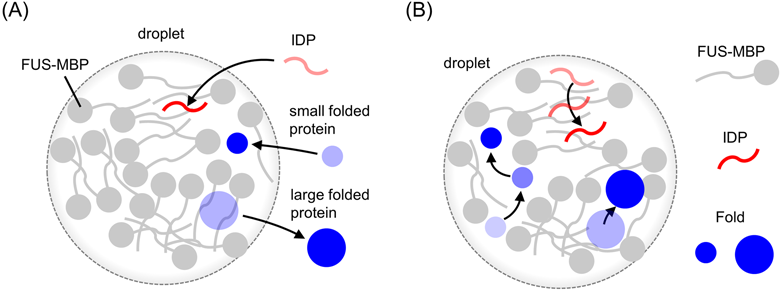
相分離液滴へのゲストタンパク質の取り込みと運動性の解析—p53やFUSをモデルとして—Molecular principles of recruitment and dynamics of guest proteins in liquid droplets of p53 and FUS
東北大学多元物質科学研究所Institute of Multidisciplinary Research for Advanced Materials, Tohoku University ◇ 〒980–8577 宮城県仙台市青葉区片平2–1–1 ◇ Katahira 2–1–1, Aoba-ku, Sendai, Miyagi 980–8577, Japan