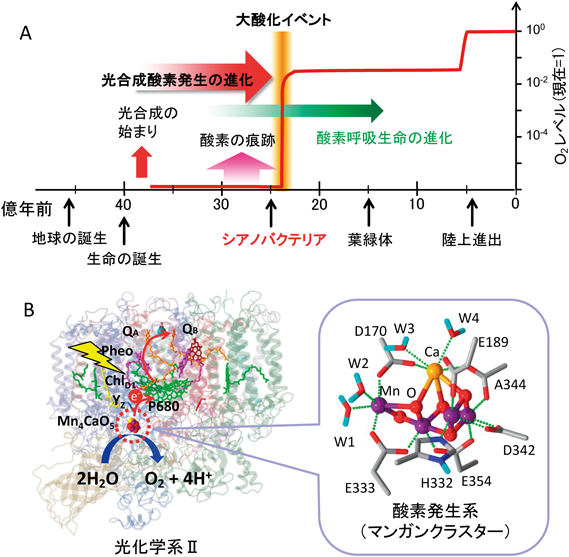
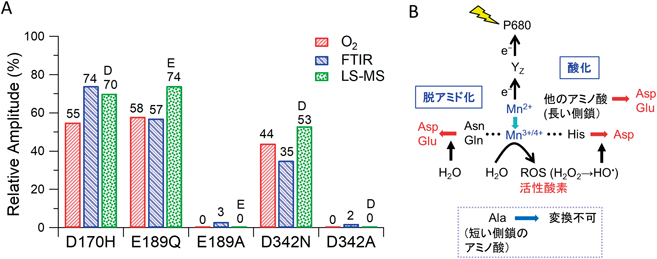
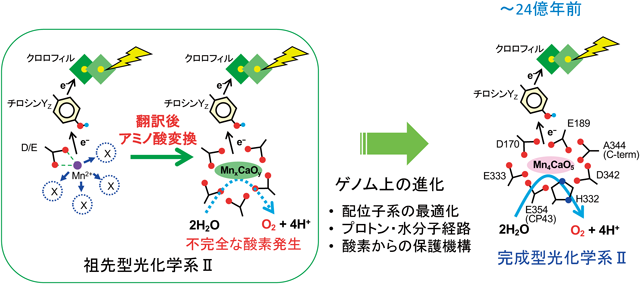
太古の地球における酸素の起源:翻訳後アミノ酸変換による光合成酸素発生系の形成Origin of oxygen on ancient Earth: Formation of the oxygen evolving complex by post-translational amino acid conversion
名古屋大学大学院理学研究科物理科学領域Department of Physics, Graduate School of Science, Nagoya University ◇ 〒464–8602 愛知県名古屋市千種区不老町 ◇ Furo-cho, Chikusa-ku, Nagoya, Aichi 464–8602, Japan