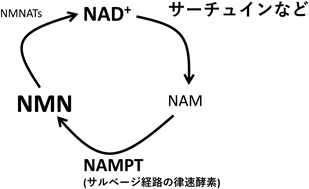
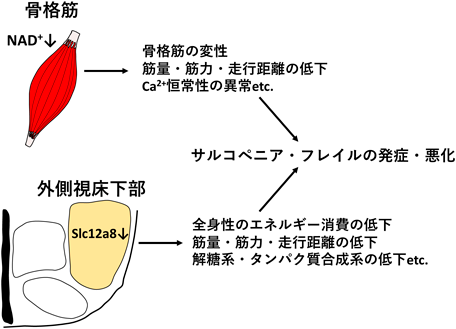
加齢によるNAD+の低下とサルコペニア・フレイルの病態Age-associated decline in NAD+ and the pathogenesis of sarcopenia and frailty
1 国立長寿医療研究センター研究所ジェロサイエンス研究センター中枢性老化–骨格筋代謝–運動機能制御研究プロジェクトチームBrain-Skeletal Muscle Connection in Aging Project Team, Geroscience Research Center, National Center for Geriatrics and Gerontology ◇ 〒474–8511 愛知県大府市森岡町7丁目430番地 ◇ 7–430 Morioka-cho, Obu-shi, Aichi 474–8511, Japan
2 ワシントン大学医学部発生生物学部門・医学部門(兼任)Department of Developmental Biology, Department of Medicine (Joint), Washington University School of Medicine ◇ MSC 8103–0012–362, 660 South Euclid Avenue, St. Louis, MO 63110, USA ◇ MSC 8103–0012–362, 660 South Euclid Avenue, St. Louis, MO 63110, USA
3 一般社団法人プロダクティブ・エイジング研究機構Institute for Research on Productive Aging (IRPA) ◇ 〒108–0075 東京都港区港南1–9–36 アレア品川13階 エキスパートオフィス品川801号室 ◇ Room 801, Expert Office Shinagawa, Aarea Shinagawa 13F, 1–9–36 Konan, Minato-ku, Tokyo 108–0075, Japan