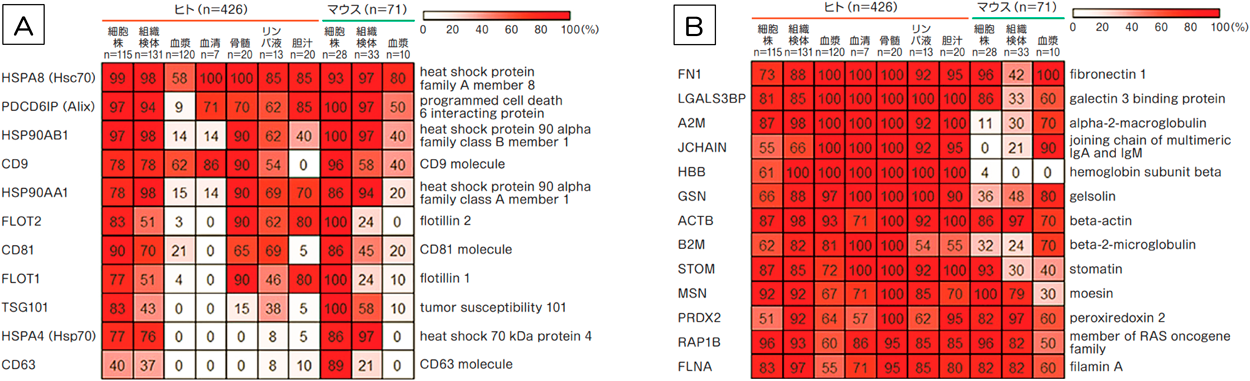
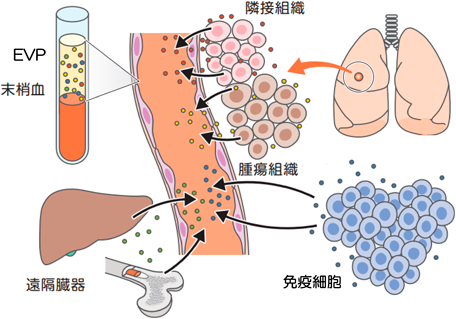
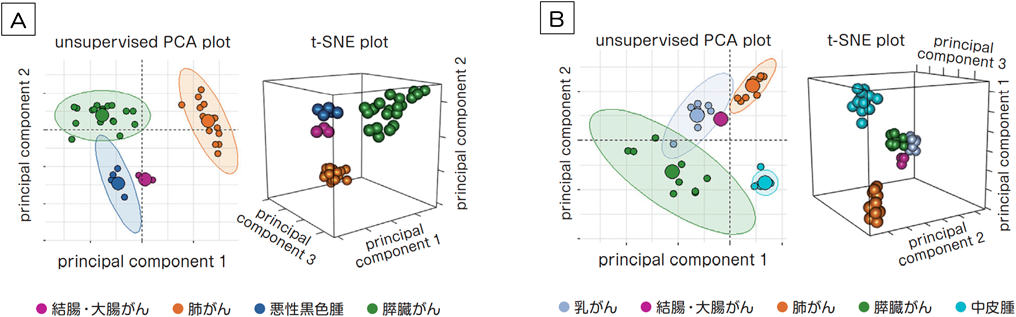
extracellular vesicle & particle(エクソソーム)が秘める可能性の探索Exploring the hidden potential of the Extracellular vesicle & particle
1 東京大学先端科学技術研究センターReserch Center for Advanced Science and Technology, The University of Tokyo ◇ 〒153–8904 東京都目黒区駒場4丁目6番1号 ◇ 4–6–1 Komaba, Meguro-ku, Tokyo 153–8904, Japan
2 東京慈恵会医科大学産婦人科学講座The Jikei University School of Medicine, Department of Obstetrics and Gynecology ◇ 〒105–8461 東京都港区西新橋3丁目25番8号 ◇ 3–25–8 Nishi-shimbashi, Minato-ku, Tokyo 105–8461, Japan
3 東京工業大学生命理工学院School of Life Science and Technology, Tokyo Institute of Technology ◇ 〒226–8501 神奈川県横浜市緑区長津田町4295 ◇ 4259 Nagatsuta-cho, Midori-ku, Yokohama, Kanagawa 226–8503, Japan