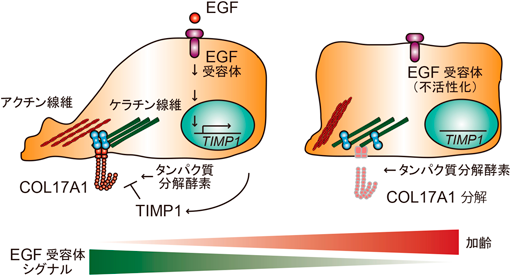
XVII型コラーゲン分解制御による表皮幹細胞の遊走制御Type XVII collagen proteolysis regulates epidermal stem cell motility
東京大学医科学研究所老化再生生物学分野Division of Aging and Regeneration, The Institute of Medical Science, The University of Tokyo ◇ 〒108–8639 東京都港区白金台4–6–1 ◇ 4–6–1 Shirokanedai, Minato-ku, Tokyo 108–8639, Japan