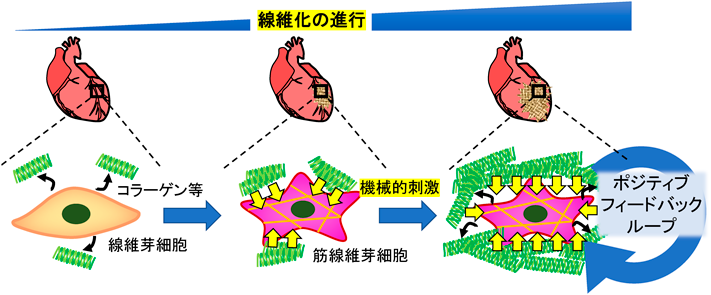
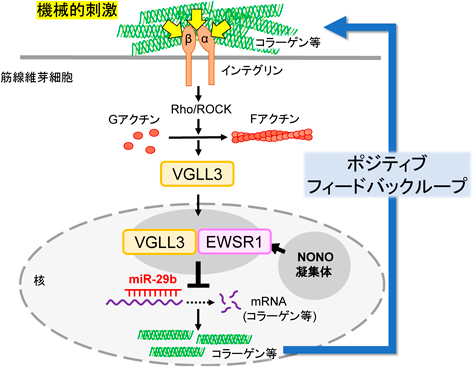
機械的刺激による筋線維芽細胞の性質変化Alteration of myofibroblast characteristics by mechanical stimulation
九州大学大学院薬学研究院疾患制御学分野Department of Disease Control, Graduate School of Pharmaceutical Sciences, Kyushu University ◇ 〒812–8582 福岡県福岡市東区馬出3–1–1 ◇ 3–1–1 Maidashi, Higashi-ku, Fukuoka 812–8582, Japan