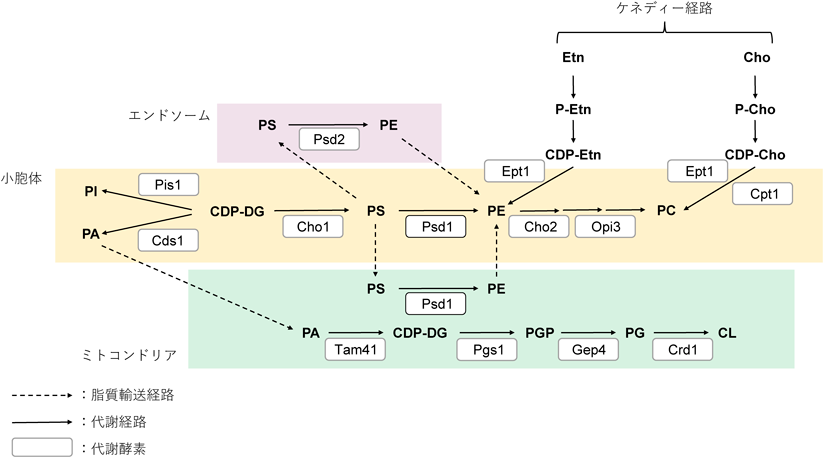
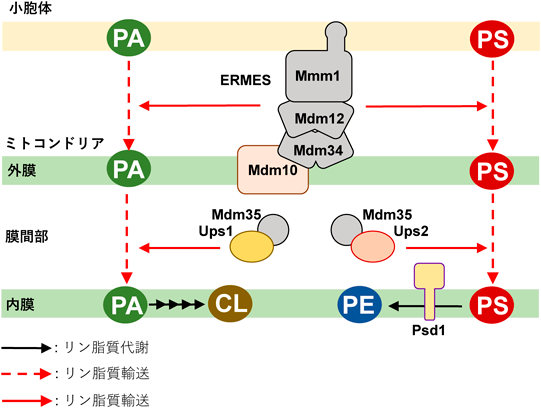
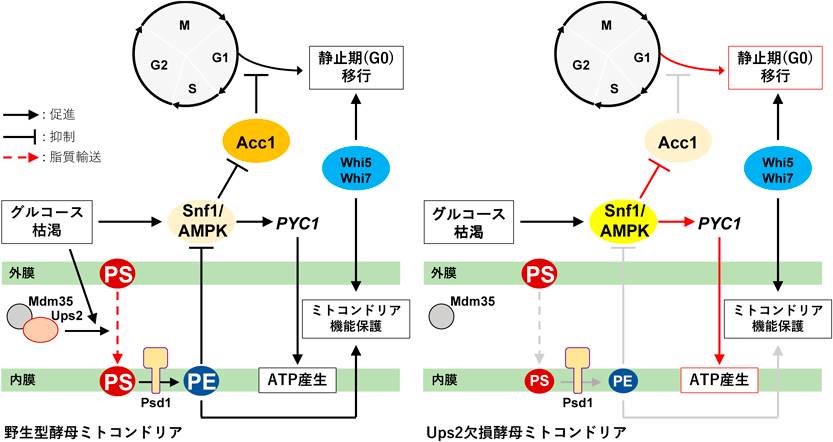
ミトコンドリア由来ホスファチジルエタノールアミンによるミトコンドリア機能,細胞増殖制御Regulation of mitochondrial function and cell proliferation via mitochondria-derived phosphatidylethanolamine
国立感染症研究所細胞化学部Department of Biochemistry and Cell Biology, National Institute of Infectious Diseases ◇ 〒162–8640 東京都新宿区戸山1–23–1 ◇ 1–23–1 Toyama, Shinjuku-ku, Tokyo 162–8640, Japan