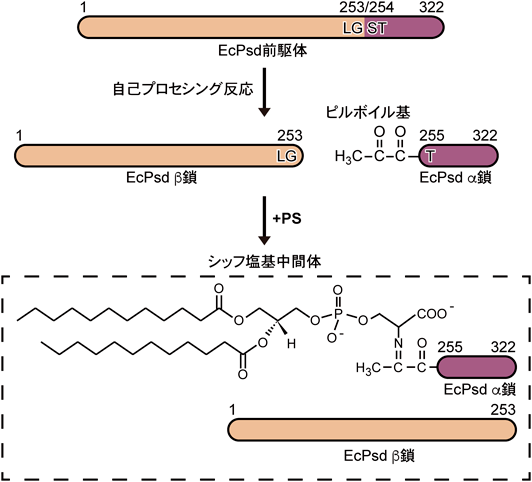
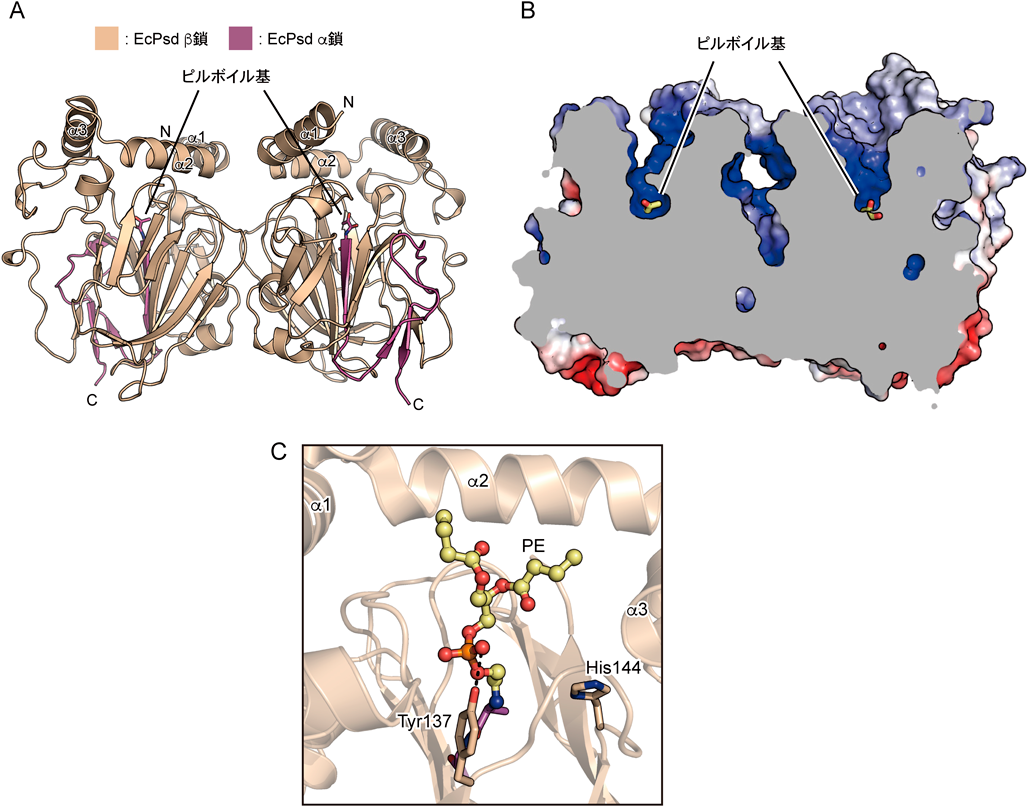
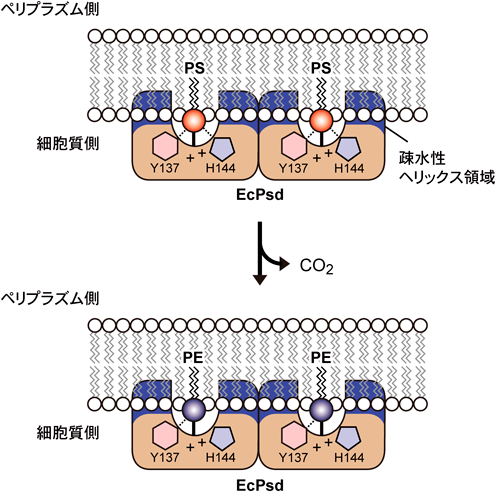
ホスファチジルセリン脱炭酸酵素PSDの生体膜上での基質認識機構Substrate recognition mechanism of phosphatidylserine decarboxylase (PSD) on the biological membrane
山形大学理学部理学科Faculty of Science, Yamagata University ◇ 〒990–8560 山形県山形市小白川町1–4–12 ◇ 1–4–12 Kojirakawa-machi, Yamagata 990–8560, Japan