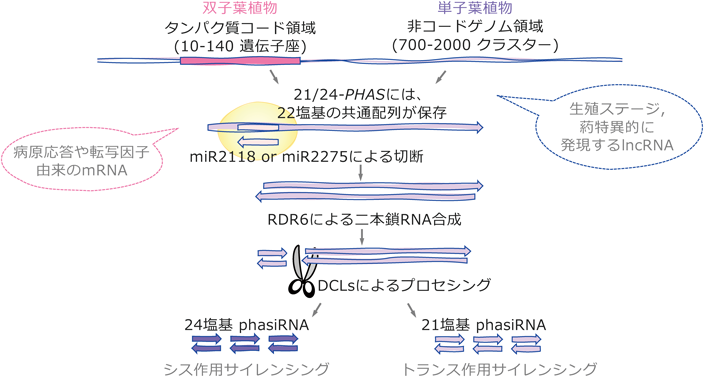
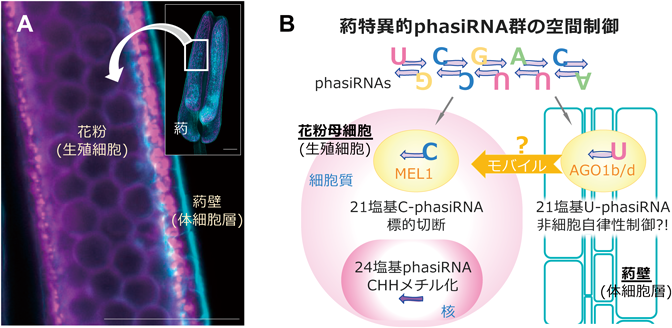
非コードゲノムに由来するphasiRNAsの雄しべサイレンシング機構Silencing system of anther-specific phasiRNAs derived from non-coding RNAs
沖縄科学技術大学院大学Okinawa Institute of Science and Technology Graduate University (OIST) ◇ 〒904–0495 沖縄県恩納村谷茶1919–1 ◇ 1919–1 Tancha, Onna-son, Okinawa 904–0495, Japan