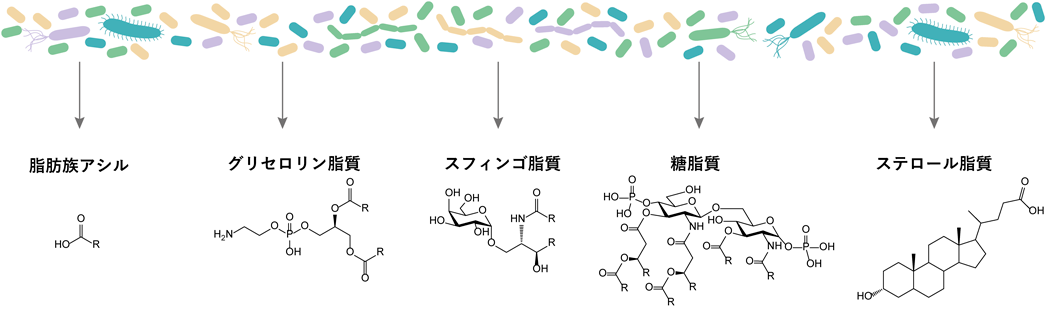
脂質は,骨格構造に基づいて体系的に分類されており,LIPID MAPSデータベースによるとこれまでにのべ45,000種以上の多様な分子種が存在することが推定されている5).まず,基本骨格の違いに基づいて脂肪族アシル,グリセロ脂質,スフィンゴ脂質,糖脂質,ステロール脂質などのカテゴリに分類され(図1),それぞれの脂質カテゴリの中に極性頭部の構造が異なる脂質クラスが存在し,それらに結合するアシル鎖の構造の違いや組合わせの数によって脂質分子種の膨大な多様性が生み出される.本稿では,各カテゴリの代表的な細菌由来脂質の構造と,作用する宿主受容体について紹介する.
1)脂肪族アシル(fatty acyls)
脂肪族アシルは,カルボキシ基を持つ炭化水素鎖で定義される.アシル鎖の炭素鎖長,不飽和度に加えて,分岐位置,ヒドロキシ基やケト基の有無など構造多様性がある.
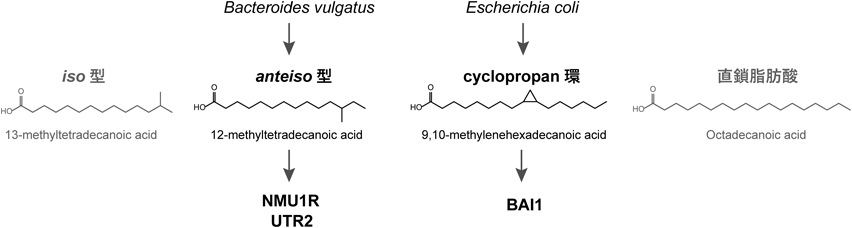
a.分岐脂肪酸,シクロプロパン脂肪酸
哺乳類には直鎖状かつ偶数炭素鎖の脂肪族アシルが多いのに対し,細菌には,炭素数が奇数でiso型やanteiso型などの分岐,シクロプロパン環を持つ脂肪族アシルが多く,その構造的差異が宿主受容体に対する親和性に影響することが報告されている.たとえば,Bacteroides vulgatus由来のanteiso型脂肪酸12-methyltetradecanoic acidは1型ニューロメジンU受容体(NMU1R)とウロテンシンII受容体(UTR2)を活性化するが,iso型の構造異性体13-methyltetradecanoic acidは,これらの受容体のリガンド活性がほとんどないことが報告されている6)(図2).大腸菌LF82株由来のシクロプロパン型脂肪酸である9,10-methylenehexadecanoic acidは,brain-specific angiogenesis inhibitor 1(BAI1)に作用する一方で,直鎖型の飽和脂肪酸のリガンド活性は低いことも示されている6)(図2).
b.水和化脂肪酸
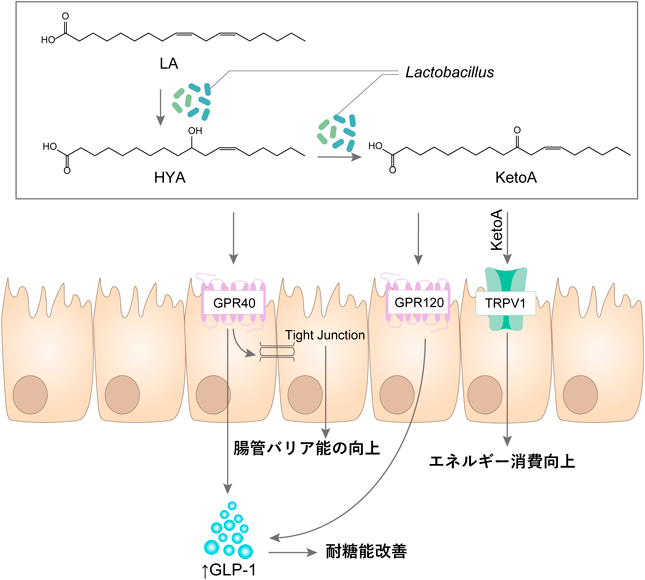
腸内細菌は,宿主や食事などに由来するリノール酸(LA),α-/γ-リノレン酸,アラキドン酸などの多価不飽和脂肪酸(polyunsaturated fatty acid:PUFA)を水和化することが知られている7).Lactobacillus plantarum AKU 1009aは,LAを基質として共役LAを合成する過程の中間体としてさまざまな機能を持つヒドロキシ脂肪酸やオキソ脂肪酸を産生する8)(図3).中でも,10-hydroxy-cis-12-octadecenoic acid(HYA)はLAよりも低濃度で長鎖脂肪酸(LCFA)受容体GPR40およびGPR120に作用する9, 10).HYAはGPR40に作用することで腸管バリア能を改善することがCaco-2細胞を用いた系で示されており,マウスへの経口投与によるデキストラン硫酸ナトリウム(DSS)誘導性大腸炎の改善効果が報告されている9).また,HYAの投与はGPR40, GPR120を介してグルカゴン様ペプチド-1(glucagon-like peptide 1:GLP-1)の放出を促進し,LA投与群と比較して大きく血中グルコース濃度を低下させることが示されている10)(図3).
一部の水和化脂肪酸中間体はイオンチャネルにも作用する.10-oxo-cis-12-octadecenoic acid(KetoA)は,transient receptor potential vanilloid 1(TRPV1)チャネルを介してミトコンドリア脱共役タンパク質(uncoupling protein 1:UCP1)の発現上昇など褐色脂肪細胞の機能を活性化することにより高脂肪食誘発体重増加を抑制する11).このように腸内細菌はメチル基やヒドロキシ基の位置が異なる多様なLCFAを産生し,それらの構造の差異が受容体に対する親和性やアゴニスト活性の違いにつながる(図3).
c.脂肪酸アミド
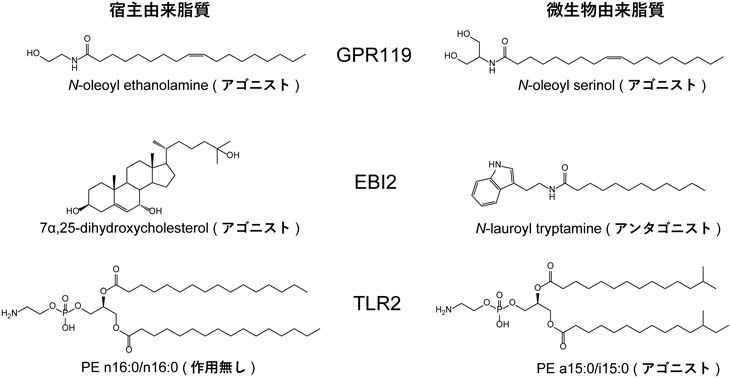
脂肪酸アミドは,脂肪酸とアミンがアミド結合した構造を持ち,宿主と細菌の両方によって生合成される.細菌の産生する脂肪酸アミドは,アシル鎖の構造や結合しているアミノ酸が宿主とは異なる.GPR119は,宿主内因性リガンドN-oleoyl ethanolamineによって活性化し,腸管L細胞におけるGLP-1放出を促進する12).一方,細菌が産生するGPR119リガンドとして見いだされたN-oleoyl serinolは,宿主内因性リガンドN-oleoyl ethanolamineと比べて同等の半数効果濃度(EC50)で最大活性が約2倍であることが報告されている.実際,無菌マウスにN-oleoyl serinol産生酵素を発現させた大腸菌を定着させると,産生酵素を発現させていない大腸菌定着群と比較してGLP-1の増加や耐糖能の向上が確認されている13).脂肪酸アミドは主にBacteroidota門およびPseudomonadota門の腸内細菌において産生が報告されていた.近年,Bacillota門に属するEubacterium ractaleの産生するN-lauroyl tryptamineが,オキシステロール受容体であるEpstein–Barr virus-induced gene 2(EBI2)のアンタゴニストとして働くことが報告された14).このように,腸内細菌が産生する特徴的な構造の脂肪酸アミドが,宿主GPCRを介して宿主の恒常性維持に影響する(図4).
2)グリセロリン脂質(glycerophospholipids)
グリセロリン脂質は,グリセロール骨格に二つのアシル鎖とリン酸を含む極性頭部を持つ.真核生物同様,原核生物も細胞膜構成脂質としてリン脂質を利用し,ホスファチジルエタノールアミン(PE)が主要な膜リン脂質であることが,大腸菌を用いた研究で明らかとなっている15).しかし現在に至るまで,細菌の持つリン脂質の標的受容体はほとんどが不明である.Baeらは,菌抽出脂質画分をマウス骨髄由来樹状細胞(mBMDC)に添加し,産生されるTNFαの量を調べることで,宿主免疫応答に深く関与していると考えられているAkkermansia muciniphilaの脂質抗原を探索した16).その結果,異なる分岐位置の脂肪酸を持つPE(anteiso C15:0-iso C15:0 PE)がToll-like receptor 2(TLR2)を強力に活性化することが報告された.興味深いことに,TLR2の活性化はanteiso型およびiso型の両方を持つPEのみで引き起こされ,同一の分岐位置脂肪酸(iso-isoもしくはanteiso-anteiso)および直鎖型の脂肪酸を持つPEはTLR2を活性化できないことが示されており16),宿主PRRは微生物由来脂質の構造を厳密に認識する(図4).
3)スフィンゴ脂質(sphingolipids)
スフィンゴ脂質は,スフィンゴイド塩基を基本骨格とする脂質分子であり,結合するアシル鎖や極性頭部の構造によって多様性がある.真核生物はスフィンゴ脂質の産生能を広く有しているが,原核生物では限定的であり,腸内細菌叢中ではBacteroidota, Alpha-ProteobacteriaおよびDelta-Proteobacteriaなどがスフィンゴ脂質を産生する17).真核生物と原核生物の産生するスフィンゴ脂質の構造は異なることが多い.一般に,細菌の産生するスフィンゴ脂質は,スフィンゴイド塩基に不飽和結合を持たず,しばしば末端が分岐している18).一方で,ヒトのスフィンゴ脂質はスフィンゴイド塩基の4位にトランス型不飽和結合を持つ直鎖構造をとる17).
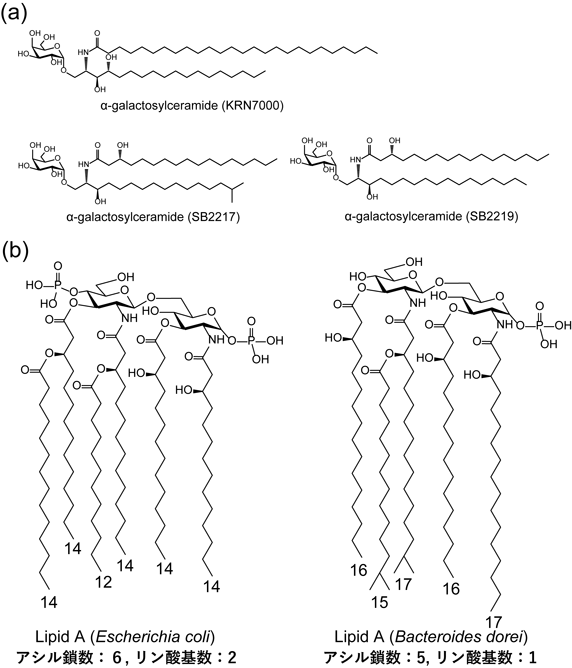
スフィンゴ糖脂質は,スフィンゴ脂質の極性頭部に糖が結合した分子である.スフィンゴ糖脂質の機能のうち最もよく研究されているのが,Bacteroides fragilisの産生するα-ガラクトシルセラミド(aGC)によるinvariant natural killer T(iNKT)細胞の制御である18–20).一般的にaGCに代表される糖脂質は,樹状細胞等に発現しているCD1dに結合し,NKT細胞のT細胞受容体に認識されることでNKT細胞を活性化させる.スフィンゴ脂質生合成初発酵素serine palmitoyl-CoA transferaseを欠損したB. fragilis株を定着させたマウスから生まれた仔は,野生型菌を定着させた群の仔よりも大腸のiNKT細胞数が増加した20)ことから,幼少期の腸内細菌叢由来のスフィンゴ脂質への曝露が宿主iNKT細胞の恒常性に大きな影響を与えることが示された.さらに同グループは,B. fragilis aGCの粗画分をCD1dリガンドであるKRN7000と共投与すると,KRN7000単独と比較してiNKT細胞によるIL-2産生量が有意に抑制されることを見いだした20).一方,Brownらは,B. fragilis aGCの粗画分が濃度依存的にiNKT細胞の活性化を部分的に誘導したが,iNKT細胞におけるIL-2産生量はKRN7000よりも低いことを報告している19).最近の研究では,さまざまな構造のアシル鎖とスフィンゴイド塩基を持つ合成aGCのiNKT細胞活性化能が検討され,スフィンゴイド塩基の末端が分岐したaGC(SB2217)は,直鎖状のaGC(SB2219)よりもiNKT細胞をより強く活性化させることが報告された18).これらの研究は,細菌のスフィンゴ糖脂質の末端構造が宿主の免疫機能調節と密接に関係していることを示している(図5a).
4)糖脂質(saccharolipids)
グラム陰性菌の持つ代表的な脂質として,リポ多糖(LPS)の疎水性アンカーを形成するLipid Aがあげられる.Lipid Aは一般的に,一つまたは複数のリン酸基を持つジグルコサミン骨格とβ-ヒドロキシ脂肪酸から構成される.最もよく研究されている大腸菌の持つLipid Aは二つのリン酸基および六つのアシル鎖を持ち,宿主PRRの一種であるToll-like receptor 4(TLR4)に対してアゴニスト活性を示す.一方で,腸内に豊富に存在する細菌の一種であるBacteroidota由来のLipid Aは,一つのリン酸基および五つのアシル鎖から構成され,TLR4アンタゴニスト活性を有する21)(図5b).幼児期におけるBacteroidotaの相対量が多いフィンランド人やエストニア人は,Bacteroidota型のLipid Aによって大腸菌型Lipid AのTLR4シグナルが阻害されることから,免疫寛容形成が不十分となり,自己免疫疾患を罹患しやすい傾向にあると考えられている21).近年の研究では,BacteroidotaのLipid Aは鎖長が異なる混合物であることや,菌種によってその存在比も異なることが報告されている22).そのため,菌株ごとに腸内細菌由来Lipid Aの詳細な構造を明らかにする必要がある.
5)ステロール脂質(sterol lipids)
腸内細菌は,コレステロールから宿主によって合成される胆汁酸類を異性化することで宿主恒常性維持に寄与する.胆汁酸は,5β-コラン酸骨格を基とする両親媒性のステロール脂質である.胆汁酸は宿主由来の一次胆汁酸と,それが細菌によって変換された二次胆汁酸に分類される.宿主肝臓でコレステロールから生合成されグリシン,タウリンなどで抱合された一次胆汁酸は,十二指腸に放出され,腸内細菌による脱抱合を経て二次胆汁酸に変換される.ヒドロキシ基の数やステロール環の立体構造が変化した二次胆汁酸は,核内受容体やGPCRに作用することで,免疫細胞の誘導等に影響する.
胆汁酸は核内受容体の一種であるファルネソイドX受容体(farnesoid X receptor:FXR)に作用することが知られている.一次胆汁酸の一種であるケノデオキシコール酸(CDCA)は,二次胆汁酸であるリトコール酸(LCA)やデオキシコール酸(DCA)よりもFXRを低濃度で活性化させる23).また,Clostridium bolteaeはチロシンもしくはフェニルアラニンで抱合されたコール酸(CA)を産生し,これらはCDCAよりも低濃度でFXRを活性化させることが報告されている24).
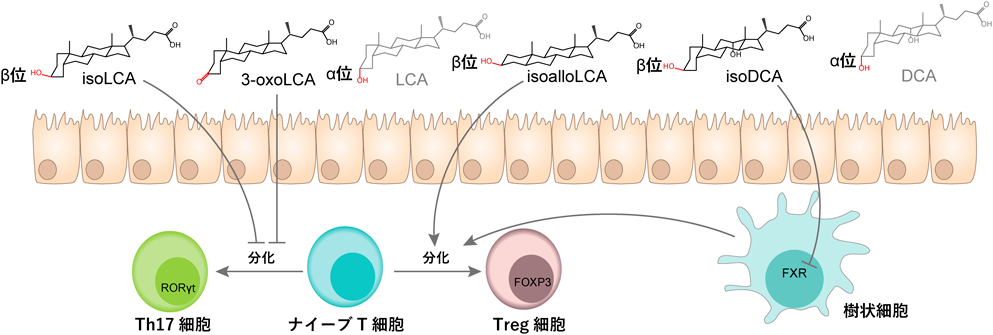
胆汁酸は宿主免疫細胞の分化誘導にも関与する.DCAの3位が細菌によってβ結合ヒドロキシ基に変換されたイソデオキシコール酸(isoDCA)は,樹状細胞のFXRに拮抗することにより,ナイーブCD4+ T細胞からTreg細胞への分化を促進する25)(図6).この効果はFoxp3の発現を亢進させるconserved non-coding sequence 1(CNS1)依存的であることが示されている.ヒドロキシ基と環の立体構造が異なるLCAの構造異性体イソアロリトコール酸(isoalloLCA)は,Treg細胞の分化を促進する26)(図6).提案されているメカニズムは,Foxp3プロモーター領域のH3K27アセチル化レベルの増加,およびナイーブCD4+ T細胞におけるミトコンドリア活性酸素種の産生の増強である26).さらに同グループは,isoalloLCAのTreg細胞誘導活性が,ナイーブCD4+ T細胞における核内ホルモン受容体(NR4A1)の欠損で著しく減少することから,NR4A1によるTreg細胞誘導メカニズムを提唱している27).また,isoalloLCAは百寿者の便中に多く存在し,グラム陽性の多剤耐性病原菌に対する抗菌活性を持つことが報告されている28).
二次胆汁酸はTh17細胞の分化抑制にも関与する.LCA生合成の中間体である3-オキソリトコール酸(3-oxoLCA)は,レチノイン酸関連オーファン受容体γt(retinoic acid-related orphan receptor γt:RORγt)に直接結合し,ナイーブCD4+ T細胞からのTh17細胞分化を抑制する26).さらに近年,同様の活性がイソリトコール酸(isoLCA)にも報告された29)(図6).Th17阻害活性がないLCAにおいてはステロールA環の3位ヒドロキシ基がα位であるが,阻害活性を有するisoLCAはこれがβ位であり,ヒドロキシ基の立体配置がRORγt結合に重要である.
GPCRの一種であるTGR5(GPBAR1)は胆汁酸によって活性化し,二次胆汁酸のLCAとDCAがその主要なリガンドである30).また,LCAはNLRP3インフラマソーム活性化を阻害し,そのメカニズムとしてTGR5活性化に伴うprotein kinase Aの活性化を介してNLRP3インフラマソームのリン酸化およびユビキチン化を促進する経路が示されている31).このことから,胆汁酸-TGR5軸は抗炎症作用に寄与する.