メタボローム(metabolome)とは代謝物の総体(metabolites+ome)を意味し,代謝物は酵素タンパク質により産生される分子量1000以下の低分子化合物を指す.これら代謝物を網羅的に計測することをメタボローム解析と呼ぶ.
1)メタボローム計測の手法
メタボローム解析には大きくターゲット分析とノンターゲット分析がある.目的とする代謝物や代謝経路が決まっている場合はそれぞれのクラスの分子(炭水化物,脂質,アミノ酸等)を対象としたターゲット分析を行う.バイオマーカー探索などターゲットが決まっていない場合はノンターゲット分析を行い,多数の代謝物質を検出できる技術を使用して,データ比較から差がある代謝物をスクリーニングする.
化学的多様性,代謝物質のさまざまな特性,およびサンプル中の代謝物質濃度のダイナミックレンジが大きいため,一つの手法だけで完全なメタボロームを測定することはほとんど不可能であり,メタボローム解析にはさまざまな手法が用いられる.メタボローム解析に用いる機器には核磁気共鳴装置(nuclear magnetic resonance:NMR),ガスクロマトグラフィー質量分析計(gas chromatography-mass spectrometer:GCMS),液体クロマトグラフィー質量分析計(liquid chromatography-MS:LCMS),キャピラリー電気泳動質量分析計(capillary electrophoresis-MS:CEMS),イメージング質量分析計(imaging MS:IMS)等がある.まず,目的とする代謝物が親水性か疎水性等により,適切な抽出法と計測法を選択する必要がある.NMR法は親水性代謝物,もしくは疎水性代謝物を広く計測することが可能であり,ノンターゲット分析にも活用できるが質量分析計と比較し感度が低いという問題がある.一方,質量分析計は高感度化が進んでいるものの,性質の異なる多数の化合物を同時に計測することは難しい.LCMSを使用した測定では,分析カラムにより保持・分離できる化合物が異なるため,性質ごとにカラムを選択し測定系を構築する必要がある.GCMSは比較的分離能が高く多成分の分析が可能であるが,不揮発性の化合物に対して誘導体化処理を行う必要があり前処理がやや煩雑になる.CEMSは他の測定系では難しいイオン性の高い化合物や幅広い親水性代謝物の測定が可能であるが,装置の操作がやや煩雑であり,生体サンプルなどの高塩濃度のサンプルでは計測が不安定になる場合もある.また,近年の新しい計測法であるIMSは,生体組織の切片など平面状の試料における各微小測定点のマススペクトルを測定することで代謝物の局在を可視化できる利点がある.
LCMS, GCMS, CEMSの用途の違いは主に化合物を分離するクロマトグラフィーに依存するが,質量分析計自体も近年急速に発展しメタボローム解析の用途が拡大している.ノンターゲット分析においては,ハイブリッド型四重極-飛行時間型質量分析計(quadrupole time-of-flight MS:Q-TOFMS)や四重極オービトラップ型質量分析計(Q-Orbitrap MS)を用いて,検出成分の精密質量とフラグメント情報をベースとした解析を行うことが可能である.また,ターゲット分析においては,高速三連四重極質量分析計(triple-quadrupole MS:TQMS)を使用することで多数の化合物に対しmulti reaction monitoring(MRM)を組むことができ,数百成分の一斉分析が可能になったことから,多成分を対象としたワイドターゲット分析に活用されている.
2)メタボロームデータの統計解析
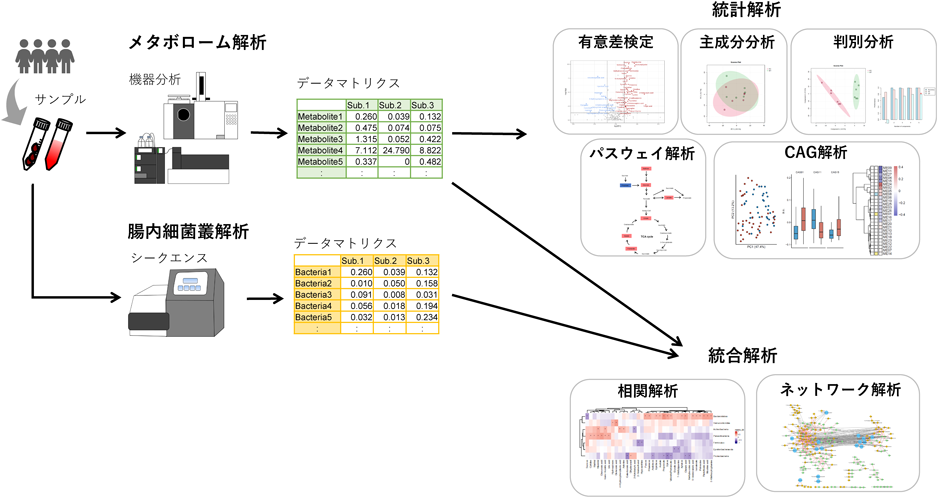
分析結果から得られた代謝物のデータマトリクスを作成後,多変量解析や代謝マップに落とし込んで解析を行う(図1).多変量解析の手法には,主成分分析,判別分析,パスウェイ解析などがある.また,腸内細菌叢のデータとメタボロームデータの統合解析として相関解析やネットワーク解析などがある.これらの解析を行うにあたり,最近では有償・無償のプログラムが提供されており,無償のものとしてはR(https://www.r-project.org)のパッケージから多数のツールが公開されている.また,MetaboAnalyst(https://www.metaboanalyst.ca/faces/home.xhtml)はMcGill大学のXia研究室が無償提供しているツールであり,直感的に使用でき初心者でも比較的使用しやすいツールである1).また,代謝経路の考察のためパスウェイ解析の方法がいくつかある.その一つとして,代謝物エンリッチメント解析(Metabolite Set Enrichment Analysis:MSEA)がある.MSEAの代表的な手法としてoverrepresentation analysisがあり,あらかじめ特定した代謝物群(2群間で差があった代謝物,クラスタリングしたときに同じクラスターの代謝物等)がどのパスウェイにてエンリッチされているかを比較する手法である.MSEAを行うツールもMetaboAnalystやRに実装されている.メタボロームデータを直接代謝経路にマッピングする方法については,KEGG(https://www.genome.jp/kegg/)データベースに実装されている,KEGG AtlasやKEGG Mapperがある.また,RのBioconductorパッケージで,KEGGパスウェイを視覚化できるツールもある.
腸内細菌研究では腸内細菌叢のデータと代謝物データの相関解析を行うことにより,特定の代謝物と腸内細菌の関連性を推測する.相関解析では,二つのデータ間の相関係数を計算し,Heatmapやネットワーク図に視覚化する.Heatmapを作成するツールはRに多数のパッケージが実装されている.ネットワーク図の作成に関しては,Cytoscape(https://cytoscape.org/)がよく用いられている.
近年では代謝物のノンターゲット解析が進みメタボローム解析から得られるデータが膨大になりつつあるため,代謝物のco-abundance group(CAG)を作成し,CAGの代表値を種々の統計解析に使用する手法も報告されている2).代謝物の変動パターンを階層的クラスタリング(hierarchical clustering:HCA)等でクラスタリングしCAGを作成し,CAGの代表値としてPCA(principal component analysis)のスコア等を使用し,CAGの比較や相関解析等を行い評価する.
3)腸内細菌研究におけるメタボローム解析
腸内細菌はさまざまな代謝物を産生することで,宿主の代謝に深く関与しているという報告が多数ある.下記に代表的な腸内細菌由来の代謝物についての機能を紹介したい.
a.短鎖脂肪酸
腸内細菌の代謝物のうち,短鎖脂肪酸(short chain fatty acids:SCFAs)である酢酸,プロピオン酸,酪酸の効果についてはこれまでに多数報告されている.我々のグループも酢酸が病原菌感染を抑制すること,酪酸が免疫応答の抑制に寄与する制御性T細胞(regulatory T cell:Treg)の分化を促進することを報告してきた3).SCFAsの受容体はGタンパク質共役受容体(GPCR)41と43等であり,これらを介してエネルギー恒常性を維持している.腸管内においては,SCFAsは腸管内分泌細胞(endocrine cell:EEC)上のGPR41とGPR43に結合し,インクレチンであるglucagon like peptide-1(GLP-1)の分泌を促進し宿主のインスリン感受性を制御する4).脂肪組織では,SCFAsによるGPR43の活性化が脂肪細胞におけるインスリンシグナル伝達を抑制し脂肪蓄積を抑制する4).このように,SCFAsは免疫,代謝において重要な役割を担っている.また一方で,SCFAsは神経変性疾患のパーキンソン病(Parkinson’s disease:PD)とも関連することが報告されている.無菌PDモデルマウスの実験から,SCFAsの経口投与により神経精神障害の悪化が報告されたが5),ヒト研究においてはPD患者の便中のSCFAs濃度は低く,炎症状態とは負の相関を示した6)という報告もあり,さらなる研究が必要ではあるが,SCFAsが脳腸軸(brain-gut axis)においても仲介的な役割を果たしていると着目されている.
b.アミノ酸
アミノ酸は通常食事から摂取されるが,腸内細菌もタンパク質を分解してアミノ酸を産生,または,新生することができる.腸内のアミノ酸の機能としては,必須アミノ酸である分岐鎖アミノ酸(branched-chain amino acid:BCAA)(バリン,ロイシン,イソロイシン)をマウスに摂食させるとAkkermiansia属の細菌やBifidobacterium属の細菌など健康増進に関与する細菌を増加させたという報告7)がある.一方,血中アミノ酸の増加は肥満や糖尿病に関わるというヒト研究が多数報告されている.前糖尿病状態の被験者の便のメタゲノム解析および血中メタボローム解析を行い,インスリン抵抗性を示す被験者では腸内細菌のBCAA産生に関する遺伝子が増加し,血中BCAAがインスリン抵抗性と相関していることが報告された8).また,肥満者の腸内細菌叢と血中メタボロームを調べた研究では,代謝異常のパラメーターと血清グルタミン酸濃度が負の相関を示していた9).このように,アミノ酸代謝が血中濃度に反映されることで肥満や糖尿病などの代謝異常に関わることが報告されているが,アミノ酸がもたらす作用のメカニズムについてはいまだ明らかとなっていない.
食事由来のトリプトファンは腸管内で吸収され,宿主のキヌレニンやセロトニン経路へ代謝される一方,腸管内では腸内細菌によりトリプトファンはインドール化合物へ分解され,aryl hydrocarbon receptor(AhR)リガンドとして機能し,宿主の免疫防御に重要な役割を担っている.AhR経路を阻害すると,インターロイキン22(Il-22)が減少し,腸管の上皮の炎症や腸管の透過性を増進させ,腸内細菌由来のリポ多糖が生体内に漏れ込むことで,肝臓での炎症やインスリン抵抗性,脂肪肝につながることが報告されている10).また,AhRリガンドはGLP-1の分泌を引き起こし,食欲の調節にも関与していることが報告されている10).その他,アミノ産由来の代謝物に関しても報告があり,ヒスチジンの代謝物質であるイミダゾールプロピオン酸は腸内細菌により産生され,肝臓においてp62のリン酸化とmTORC1の活性化を介してインスリン抵抗性を悪化させることが報告されている11).また,腸内細菌の代謝物質であるトリプトファン由来のインドールがマウスの白色脂肪細胞におけるmiR-181ファミリーの発現を制御し,エネルギー消費とインスリン感受性を調節することも報告されている12).
c.胆汁酸
胆汁酸は肝臓で産生され十二指腸乳頭部から分泌されて脂質の吸収に寄与する.大部分は回腸末端にて再吸収されるが,一部の胆汁酸は大腸に移行し腸内細菌の代謝を受け二次胆汁酸として存在する.この腸内細菌が産生する二次胆汁酸が肝臓がんを誘発することが報告されている13).また,二次胆汁酸である3-oxo-lithocholic acid(LCA)が炎症を誘導するT helper 17(Th17)細胞の分化を抑制し,isoalloLCAがTregの分化促進活性があることが報告されており,二次胆汁酸が宿主免疫系へも影響することが明らかとなってきている14).
d.神経伝達物質
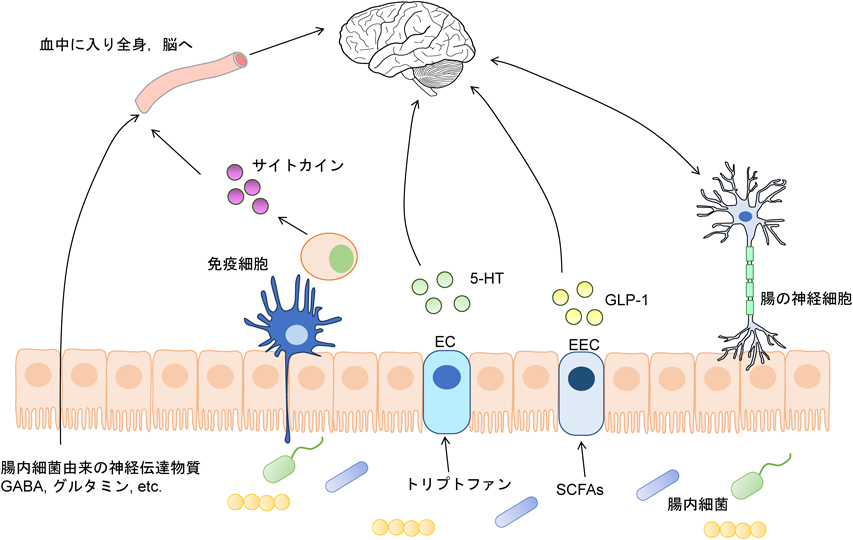
脳腸軸は腸と中枢神経系をつなぐ双方向通信ネットワークであり,近年,腸内細菌の産生する代謝物がこのネットワークにも深く関与することが報告されている(図2).ドーパミン,ノルアドレナリン,セロトニン,GABA,アセチルコリン,ヒスタミン,グルタミンは神経伝達物質として知られているが,これらを直接腸内細菌が産生できることも報告されている15).またSCFAsのような小さな分子の代謝物は,腸管を透過し血中に取り込まれると脳関門を通過して脳に直接入り作用することも報告されている.前述したが,EECは腸管内のSCFAsを認識しGLP-1を分泌する.腸管内のトリプトファンを腸クロム親和性細胞(enterochromaffin cell:EC)が吸収しセロトニン(5-hydroxytryptamine:5-HT)を産生して分泌する.ECが産生する5-HTは全身の80%以上であることが報告されている16).また,腸管の免疫細胞は腸内細菌を認識してサイトカインを産生し,産生されたサイトカインは血中を通して全身を巡り,脳にも作用する.