我々の腸管には1000種類にも及ぶ細菌が生息しており,腸内細菌と呼ばれている.腸内細菌の機能や役割に関する研究は世界中で精力的に進められており,我々の健康状態や疾患の発症・重篤化などと関わっていることが明らかになってきている.一方で,我々が摂取した食物は咀嚼や胃腸の蠕動運動などの物理的活動や消化酵素により消化され,腸管上皮から吸収されるが,これら生体による消化機能に加えて腸内細菌も難消化性の食物繊維や多糖類などを分解し,消化を助けている.また,一部の腸内細菌はビタミンやアミノ酸などを合成し,食事以外からの栄養素の供給源となっている.このように,腸内環境は食事に由来する食品成分や栄養素,腸内細菌などの常在微生物やその代謝物,腸管上皮などの宿主の少なくとも三者によって形成されており,腸内環境と健康や疾患の関連を明らかにするためには,「食事–腸内細菌–宿主」の相互作用を包括的に理解することが必要となる.
このような背景の中で,腸内環境を改善し健康の維持や増進に役立てるため,生体にとって有益な働きを持つ微生物はプロバイオティクスとして,また有用な微生物を増やす・機能を高めるような食品などはプレバイオティクスとして利用され,一般にも広く認知されるようになってきた.さらに,最近のメタボローム解析技術の発展などにより,これまで菌そのものを対象としてきた研究や製品開発は,腸内細菌が作り出し宿主に対して生理活性を持つ代謝物に注目がシフトしつつある.その中でも特に,食品成分を基質として菌が作り出す代謝物のうち生体にとって有益な働きをするものは「ポストバイオティクス」と呼ばれ,食品業界やヘルスケア産業などの領域から注目されている.そこで本稿では“食と腸内細菌が織りなす腸内代謝環境”と題して,腸内細菌による代謝という観点から食事や健康との関連を含めて腸内環境について考えてみたい.
腸内細菌の多くは難培養性であることから,次世代シーケンサーを用いた16S RNA菌叢解析などの遺伝子レベルでの解析によって細菌種の構成や多様性などが評価されている.また,個々の微生物を解析するのではなく,腸内細菌叢を一つの生命体と捉え,ショットガンメタゲノム解析によって腸内細菌叢の全ゲノム情報を一括して取得・解析することで細菌叢全体としての機能的な特徴を解析することができる.これまでの研究から,ヒトの腸管には主にFirmicutes, Bacteroidetes, Actinobacteria, Proteobacteriaの四つの門に分類される1000種類近くの細菌種が存在しており,また,その種類や構成はヒトによって異なることが明らかになっている.たとえば,人種や国の違いという観点から,日本人では欧米人や中国人に比べて,Actinobacteria門のビフィズス菌(Bifidobacterium)やFirmicutes門のブラウティア菌(Blautia)の割合が多いという特徴が報告されており1),その背景には宿主の遺伝的な要因に加えて,食文化などの長年の生活様式の違いによる影響があると考えられている.また,ヒトの腸内細菌叢は年齢とともに変化することが指摘されており,成人に比べて乳児ではビフィズス菌などのActinobacteria門やProteobacteria門の細菌の割合が多く,高齢者ではウエルシュ菌(Clostridium perfringens)などの割合が増加することが報告されている2).筆者らのグループでも令和3年度末までに約7000名のデータ収集を行い,そのうち約1500名の日本人を対象とした観察研究から,腸内細菌叢と年齢や性別,食事などの生活習慣に関連があることを報告している3).特に二つの独立したコホートにおいて,年齢,性別,body mass index(BMI),排便状況,食事(ビールなどのアルコール,スイーツ,魚などの摂取),勤務状況が共通して腸内細菌叢と関連していることが明らかになった.このように腸内細菌叢はさまざまな遺伝的および環境的な影響を受けて形成されている.
3. 腸内細菌が産生する酪酸と食事由来のビタミンB1の関連
腸内細菌が産生する代謝物についても,メタボロームやNMR解析などによる代謝物の同定や定量的分析が可能である.腸内細菌が難消化性の食物繊維や多糖類を分解して,酢酸や酪酸などの短鎖脂肪酸へと変換することは有名である.興味深いことに,短鎖脂肪酸は腸管のエネルギー源となり,蠕動運動などの腸管の働きを促進するとともに,特異的な受容体を介して腸管上皮細胞や免疫細胞の機能を制御している4).
では,食物繊維をたくさん摂取すれば酪酸は増えるのだろうか.少なくとも筆者らが行った日本人を対象とした横断研究において,食事における食物繊維の摂取量と便中の酪酸量に相関関係は認められず,食事由来のビタミンB1摂取が重要であることが示唆された5).すなわち,ビタミンB1はRuminococcaceae科の腸内細菌などの酪酸産生菌が糖質や酢酸を酪酸へ変換する代謝経路において補酵素として働くことから,基質となる食物繊維などを十分に摂取し,代謝できる腸内細菌が存在していても,ビタミンB1が不足していると代謝反応が円滑に進まないため,代謝物である酪酸が産生されないことが明らかになった5).
このような知見からも,食と腸内細菌の相互作用によって腸内環境が形成されており,腸内細菌による代謝を理解することが重要であると考えられる.
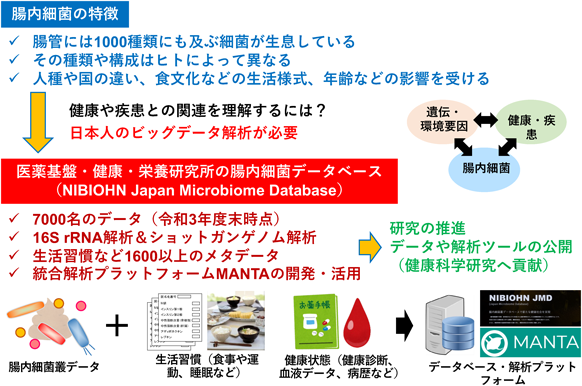
腸内環境はさまざまな遺伝的および環境的要因の影響を受けて形成されるため,腸内環境と健康や疾患との関連を理解するためには,腸内細菌叢やメタボロームなどの腸内環境そのものに関する情報に加えて,対象者の年齢,性別,人種,国や地域などの生活環境,食生活,疾患情報などのさまざまな情報を同時に収集し,解析する必要がある(図1).さらには,得られたビッグデータを情報学や統計学に加えて機械学習や深層学習などの人工知能も駆使したバイオインフォマティクスの手法を活用し解析することが必要となる.また,日本人における腸内環境の機能や役割を理解するためには,日本人におけるデータを収集し,研究を行うことが重要であると考えられる(図1).
筆者らのグループでは,日本人を対象に16S rRNA配列をもとにした腸内細菌の種類や構成に加えて,ショットガンゲノム解析による機能遺伝子解析などの腸内細菌叢の全ゲノムデータ,食事や運動などの生活習慣,血液データなどの健康指標や疾患情報など1600以上のメタデータを含む日本人の腸内細菌データベースNIBIOHN JMD(Japan Microbiome Database)を構築し,独自に開発した統合解析プラットフォームであるMANTAを用い自らの研究を推進するとともに,ビッグデータを活用した健康科学研究の一助になることを期待して,可能な範囲でデータや解析ツールを公開している(図1)(https://microbiome.nibiohn.go.jp/)6, 7).
このようなビッグデータを用いたヒト研究などから,さまざまな疾患において腸内細菌との関連が指摘されており,そこでは,炎症性腸疾患や過敏性腸症候群,大腸がんなどの消化器疾患だけではなく,肥満や糖尿病などの生活習慣病を含め,アレルギーやアトピー,関節リウマチなどの免疫疾患,アルツハイマーやうつ病などの脳神経疾患など,一見すると腸とは関係がないようなさまざまな疾患患者において腸内細菌叢の構成の変化や多様性の低下などが報告されている8–10).
また,このような腸内細菌叢の変化は病気が発症した結果ではなく,発症や増悪化を引き起こすリスク因子となることが明らかになってきている.たとえば,腸内細菌叢の変化が報告されている肥満者の腸内細菌を無菌マウスへ移植すると,マウスの体重が増加し肥満となったことから,腸内細菌叢の変化は肥満に直接影響する要因となることがわかる8).このような体重に関わる腸内細菌に関しては,ヨーロッパの研究グループを中心に,肥満や糖尿病を予防・改善できる腸内細菌としてアッカーマンシア菌(Akkermansia)が同定されている11, 12).このように,腸内環境を改善することで疾患の予防や治療標的になりうると期待されている.実際に,肥満やインスリン抵抗性の被験者を対象とした介入試験において,アッカーマンシア菌の摂取により,インスリン感受性の向上,血中コレステロール値の低下,体重の減少などの改善効果が確認されており13),2021年には低温殺菌したアッカーマンシア菌が体重コントロールのための食品として承認され,現在,実用化が進められている.
このように,肥満や糖尿病の原因として食べ過ぎや運動不足などの生活習慣に加えて,我々の腸管の中に生息している腸内細菌の関与が強く示唆されており,腸内環境を改善することで肥満や糖尿病を制御できる可能性が示されている.
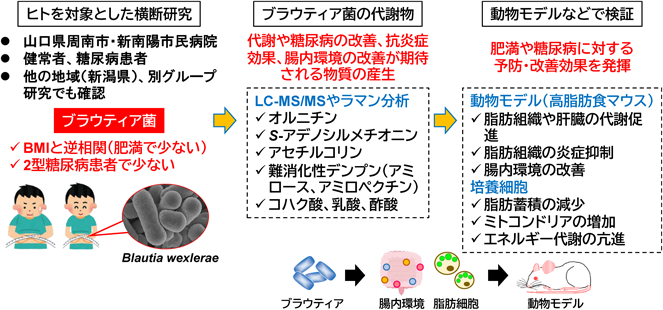
筆者らが所属する医薬基盤・健康・栄養研究所は,国民・市民の健康増進に寄与することを目的として,山口県周南市および新南陽市民病院と連携・協力して調査研究を行うための連携協定を2017年に締結し,肥満や糖尿病などの生活習慣病などの新しい予防・改善法の確立と健康社会実現の促進に向けた研究に取り組んでいる.その中で217名の被験者を対象とした横断研究から,BMIもしくは2型糖尿病と関連のある複数の腸内細菌を同定した14).具体的には,体によい善玉菌として認知されてきているビフィズス菌や酪酸産生菌であるフィーカリバクテリウム菌(Faecalibacterium)に加えて,ブラウティア菌の割合が,肥満でない方や糖尿病患者でない方で多いことが判明した(図2).
そこで,ブラウティア菌の抗肥満・抗糖尿病効果を検証するため,高脂肪食負荷マウスにブラウティア菌を摂取させたところ,内臓脂肪の蓄積抑制を伴う体重の増加抑制が確認された.さらに,本モデルは肥満とともに2型糖尿病を発症するため,糖尿病に伴う指標を検討した結果,通常食マウスに比べて高脂肪食マウスで上昇していた空腹時血糖値と血中インスリン濃度,インスリン抵抗性の指標であるHOMA-IRが低下し,グルコース負荷試験においても血糖値上昇の抑制が認められた(図2).このように,日本人コホートならびに動物モデルを用いた検証から,ブラウティア菌は脂肪の蓄積を抑えて肥満や糖尿病を予防できることが明らかになった14).
ブラウティア菌と肥満の関連については,筆者らが新潟県で別途行った調査においても山口県と同様に健常者に比べて肥満者でブラウティア菌の割合が少ないことが明らかになっており14),また,弘前大学などが行った日本人を対象とした観察研究において,ブラウティア菌の割合が多いと内臓脂肪蓄積が少ないという結果が報告されており15),日本人を対象とした複数のコホートでブラウティア菌の有用性を示唆する結果が得られている.
7. ブラウティア菌が産生する代謝物と作用メカニズム
筆者らはブラウティア菌の抗肥満・抗糖尿病効果のメカニズムを理解する目的で,脂肪細胞を用いた培養系での脂肪蓄積の評価を行った.その結果,ブラウティア菌の培養上清の作用により,細胞内の脂肪蓄積が抑制されたことから,ブラウティア菌から分泌される成分に実効物質が含まれていることが示唆された.そこで,ゲノム情報やメタボローム,ラマン分析などを組み合わせたオミクス解析を実施したところ,ブラウティア菌は脂肪蓄積抑制効果があるオルニチン,アセチルコリン,S-アデノシルメチオニンなどのユニークなアミノ酸代謝物を産生していることが明らかになった(図2).さらに,これらの代謝物は脂質代謝だけではなく,炎症やミトコンドリア機能の制御にも関わっていることが知られている.実際に,ブラウティア菌の摂取により,高脂肪食負荷で誘導される脂肪組織におけるマクロファージの浸潤を伴う炎症が抑制されていた.また,コハク酸などのエネルギー代謝マーカーが脂肪組織や肝臓で増加しており,高脂肪食負荷で低下していたミトコンドリア代謝が促進されていることが示唆された.このように,ブラウティア菌は有用代謝物の産生を介して,脂肪蓄積を抑制するとともに,抗炎症やミトコンドリア代謝促進効果を発揮し,肥満や糖尿病を制御していると考えられる14).
また,ラマン分析などから,ブラウティア菌の菌体内にアミロペクチンが蓄積していることも見いだしている.アミロペクチンは,多数のグルコースがα1–4結合に加えてα1–6結合で分岐した構造を持つ多糖であり,植物に豊富に含まれる難消化性デンプンとして知られている.難消化性のデンプンやオリゴ糖,食物繊維などには腸内環境を改善する働きがあることから,腸内環境への影響を検討したところ,ブラウティア菌の摂取により,高脂肪食負荷マウスの腸内細菌叢が変化しており,これに伴って便中の短鎖脂肪酸(酢酸,プロピオン酸,酪酸)が増加していたことから,ブラウティア菌により腸内環境が改善していると考えられた(図2).さらに,興味深いことに,ブラウティア菌自体の短鎖脂肪酸産生能を評価したところ,酢酸を多く産生するものの,プロピオン酸や酪酸はわずかしか産生しないことが明らかになった.すなわち,マウス腸管におけるプロピオン酸や酪酸の増加は,ブラウティア菌の産生による直接的な作用ではなく,他の腸内細菌を介したものであると考えられた.このメカニズムとしては,培養系においてブラウティア菌が酪酸産生菌の一種であるButyricicoccusの増殖と酪酸産生を促進すること,また,ヒトデータにおいてもブラウティア菌とButyricicoccusの割合が正に相関することから,ブラウティア菌はcross feedingを介した他の短鎖脂肪酸産生菌との相互作用により,腸内環境を改善していると考えられる.
このように,ブラウティア菌は食事成分などを代謝し,生体にとって有益な働きを持つ代謝物を産生することで,脂肪組織などの生体機能を制御,腸内環境を改善し,肥満および糖尿病を抑制していると考えられる14).
8. 食事から摂取した脂肪酸の生体内代謝と代謝物の生理作用
このように,腸内細菌は食事成分などを代謝し,さまざまな代謝物を産生しており,その中には高い生理活性を持つ代謝物が含まれており,生体機能や健康状態の制御にも影響を及ぼしている.ブラウティア菌は腸内細菌に着眼した研究アプローチであるが,食事成分や代謝物の観点からの研究アプローチの例として,食用油に含まれる脂肪酸とその代謝物に着目した研究について紹介する(図3).
脂質は細胞膜の構成成分やエネルギー源として働き,我々の体にとって必須の栄養素である.筆者らのグループでは,食用油に含まれる脂肪酸に着目し,免疫への影響や疾患との関わりについて研究を進めている.食用油にはさまざまな脂肪酸が含まれるが,中でもω3脂肪酸とω6脂肪酸は体内で合成できず,外部から摂取する必要がある必須脂肪酸であることから,食事の影響が大きい.たとえば,ω3脂肪酸であるαリノレン酸を多く含む亜麻仁油,もしくは,実験用マウスの通常エサに使用されω6脂肪酸であるリノール酸を多く含む大豆油で飼育したマウスの腸管組織では,それぞれαリノレン酸とリノール酸の蓄積が認められ,食事から摂取した脂肪酸,特に必須脂肪酸の組成は生体内の脂肪酸組成に反映されることがあらためて確認された16).
このような食事から摂取する脂肪酸の違いが,各種アレルギーや炎症の発症に影響を与えることが動物モデルを用いた検討から明らかとなっている.たとえば,卵アレルギーモデルを適用すると,亜麻仁油で飼育したマウスでは大豆油で飼育したマウスに比べてアレルギー性下痢の発症が顕著に抑制され,その結果と相関し,アレルギーの発症に関わるマスト細胞の脱顆粒の抑制が観察された16).
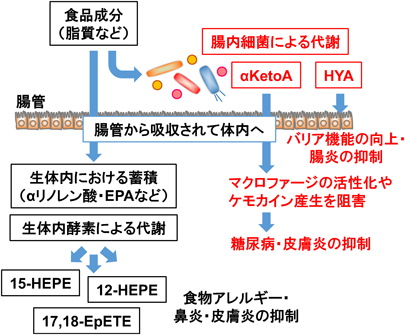
生体内において脂肪酸はさまざまな酵素によって代謝され,多種多様な脂肪酸代謝物へと変換され,免疫をはじめとする生体機能に影響を与える.そこで,メタボローム解析により,亜麻仁油に多く含まれるαリノレン酸を起点に産生される脂肪酸代謝物を網羅的に解析したところ,αリノレン酸から代謝・産生されるエイコサペンタエン酸(EPA)を基質にシトクロムP450(CYP)酵素によって代謝・産生される17,18-epoxyeicosatetraenoic acid(17,18-EpETE)が腸管組織において増加し,アレルギー性下痢の発症を抑制する実効分子の一つとして機能することが明らかになった16).さらに筆者らのその後の研究から,亜麻仁油摂取によるアレルギー性鼻炎の抑制においては,鼻腔の好酸球によって産生される15-hydroxyeicosapentaenoic acid(15-HEPE)17)が,接触皮膚炎の抑制においては,皮膚組織において産生される12-hydroxyeicosapentaenoic acid(12-HEPE)18)がそれぞれ実効分子として機能していることを明らかにしている.
このように,食事から摂取された食用油や脂肪酸は生体内で代謝されて,高い生理活性を持つ脂肪酸代謝物へと変換され,さまざまな生理作用を発揮することが明らかになっている.
脂肪酸の代謝に関わるのは生体内の酵素だけではなく,腸内細菌が持つ酵素も関与する(図3).たとえば,10-oxo-cis-12-cis-15-octadecadienoic acid(αKetoA)は,亜麻仁油で飼育したマウスの便において大豆油で飼育したマウスに比べて顕著に増加し,また,亜麻仁油で飼育しても腸内細菌がいない無菌マウスの便では顕著に少ない19).このことは,αKetoAが食事から摂取するαリノレン酸を起点として腸内細菌の代謝に依存して産生されていることを示している.すなわち,腸内細菌は宿主とは異なる代謝酵素や経路によってユニークな代謝物を産生している.
興味深いことに,腸内細菌によって腸管で産生された脂肪酸代謝物は体内に吸収された後,免疫制御機能を発揮する(図3).たとえば,αKetoAはperoxisome proliferator-activated receptor-γ受容体を介して炎症性マクロファージの分化やケモカイン産生などを阻害することで,糖尿病や接触皮膚炎を抑制できることを明らかにしている19).他にも,リノール酸を起点に産生される腸内細菌由来の代謝物である10-hydroxy-cis-12-octadecenoic acid(HYA)がGPR40のリガンドとして機能し,腸管上皮におけるタイトジャンクション関連分子の発現を増強することで腸管のバリア機能を向上させること,さらに,NF-κB経路を抑制することで腸炎を抑制することなども報告されており,腸内細菌がユニークに産生し生理活性を持つ脂肪酸代謝物が見いだされている(図3)20).
このように,食品成分は生体内酵素だけではなく,腸内細菌によるユニークな代謝を受けて,ポストバイオティクスなどのさまざまな生理活性を持つ代謝物へと変換されることで健康効果など生体機能へ影響を与えている.
上述したように,亜麻仁油の抗アレルギー・抗炎症効果において,その実効分子は疾患ごとに異なることが明らかになってきた.このような違いを説明する一つの要因として,疾患の発症部位となるそれぞれの組織における発現代謝酵素の種類や発現量に差があることを見いだしている.たとえば,腸管ではCYPの発現が高いため,17,18-EpETEが高産生されるが,皮膚ではCYPの発現が低い代わりに12-リポキシゲナーゼ(12-LOX)という代謝酵素の発現が高いので,基質が同じでも腸管とは異なり皮膚では12-HEPEが産生される18).このように,各組織における酵素の発現や活性の違いが代謝物のプロファイルへ反映されると考えられる.
このように,一個体の中でも器官や組織によって代謝・産生される代謝物には違いがある.さらに,ヒトではCYPなどの酵素には多くのサブタイプや遺伝子多型が存在し,その活性はヒトによって異なる.これらを考慮すると,同じ量のω3脂肪酸を摂取したとしても体内で生成される脂肪酸代謝物の種類や量,分布は人によって異なると予想される.つまり,食事成分の生体への影響には代謝機能の違いのために個人差が生じることになる.
さらに,生体内酵素のサブタイプや遺伝子多型などのバリエーションに加えて,腸内細菌の種類や構成がヒトによって異なることを考えると,食品の健康効果に個人差があることは当然のことであり,今後の研究では,この個人差を解明していくことが重要になると考えている.実際に,ヒトの便中のαKetoA量を測定してみると,基質となるαリノレン酸の量と相関はあるものの,同程度のαリノレン酸量を示す人でもαKetoA量には100倍程度の差があり,αKetoAへの変換効率に大きな個人差があることがわかる19).
11. 腸内細菌の違いから食品成分の代謝や健康効果を予測する
筆者らは,このような「個人差」という課題に対して,個人ごとにおける食品の効果を予測し,最適な食品を選択できる個別化栄養の発展が重要であると考えている.最後に,腸内細菌データに基づいた個別化・層別化の可能性について紹介したい.
大麦は,イネ科の穀物でビールの原料としてもよく知られているが,最近では麦ごはんやもち麦,雑穀米,大麦パンなどの形で主食としても喫食されている.同じ穀物の中でも,白米や小麦などに比べて食物繊維を豊富に含んでいることから,最近では健康にいい食材としても認知されてきている.実際に,大麦由来の水溶性食物繊維であるβグルカンには,食後血糖値の急激な上昇の抑制,代謝促進などの働きがあり,脂質異常症や高血圧症,糖尿病などを改善・抑制できると期待されている.βグルカンがこのような健康効果を発揮するメカニズムの一つとして,腸管において腸内細菌がβグルカンなどの食物繊維を代謝すると,代謝促進などの効果を持つ酢酸や酪酸などの短鎖脂肪酸へと変換されることから,腸内細菌による代謝が重要だと考えられている.
そこで筆者らのグループでは脂質異常症を対象に,大麦摂取の効果における腸内細菌の関与の可能性について検討した.具体的には,観察研究の参加者について,大麦の摂取量が多い人の中で,脂質異常症である人をノンレスポンダー(大麦の効果が現れていない),脂質異常症でない人をレスポンダー(大麦の効果が現れている)と定義して,レスポンダーとノンレスポンダーの腸内細菌叢を比較した.その結果,レスポンダーはノンレスポンダーに比べて,腸内細菌叢の多様性が高く,酢酸や酪酸などの短鎖脂肪酸を産生するビフィズス菌やフィーカリバクテリウム菌などの割合が多かった21).このように,レスポンダーとノンレスポンダーでは腸内細菌叢に違いがみられたことから,大麦摂取の効果において腸内細菌が関連していると考えられた.そこで,機械学習の手法を使って,脂質異常症を対象に大麦摂取の効果を予測するモデル構築を試みたところ,レスポンダーとノンレスポンダーを区別できる判別モデルを構築できた21).
他にも,亜麻仁油に豊富に含まれるポリフェノールの一種であるリグナンから腸内細菌によって変換・産生され,健康効果が期待されるエンテロラクトンなどへの代謝を判定できる機械学習モデルも構築しており22),腸内細菌のデータにより食品(大麦)の健康効果や代謝物の産生を予測し,個別化・層別化栄養を実現できる可能性が示されたと考えている.
腸内細菌は,我々が摂取した食品成分の少なくとも一部を代謝し,ポストバイオティクスなど高い生理活性を持つ代謝物を産生しており,我々の健康や疾患と深く関わっている.一方で,同じ名前の菌であっても機能遺伝子の有無や変異のため代謝能や活性が異なり,また,異なる名前の菌が同じ代謝能を持つことが考えられる.そこで,腸内環境と健康の関連を理解するためには,腸内細菌による代謝の観点から,食事の影響なども含めて腸内代謝環境を解明することが必要であると考えられる.
さらに,腸内細菌の種類や構成が個人ごとに異なることを考えると,同じ食品を摂取しても腸内での代謝や宿主への効果には個人差が生じることは明白である.そこで,“腸内細菌による代謝”をキーワードに「食–腸内細菌–宿主」の三者間の相互作用を包括的に理解することで,将来的には個人ごとに食品やプレ・プロバイオティクスなどの効果を予測し,最適な食事や製品を選択できるなどの個別化/層別化栄養・ヘルスケアの実現が健康科学の展望として期待されるところである.
引用文献References
1) Nishijima, S., Suda, W., Oshima, K., Kim, S.W., Hirose, Y., Morita, H., & Hattori, M. (2016) The gut microbiome of healthy Japanese and its microbial and functional uniqueness. DNA Res., 23, 125–133.
2) Odamaki, T., Kato, K., Sugahara, H., Hashikura, N., Takahashi, S., Xiao, J.Z., Abe, F., & Osawa, R. (2016) Age-related changes in gut microbiota composition from newborn to centenarian: a cross-sectional study. BMC Microbiol., 16, 90.
3) Park, J., Kato, K., Murakami, H., Hosomi, K., Tanisawa, K., Nakagata, T., Ohno, H., Konishi, K., Kawashima, H., Chen, Y.A., et al. (2021) Comprehensive analysis of gut microbiota of a healthy population and covariates affecting microbial variation in two large Japanese cohorts. BMC Microbiol., 21, 151.
4) Kimura, I., Ichimura, A., Ohue-Kitano, R., & Igarashi, M. (2020) Free fatty acid receptors in health and disease. Physiol. Rev., 100, 171–210.
5) Park, J., Hosomi, K., Kawashima, H., Chen, Y.A., Mohsen, A., Ohno, H., Konishi, K., Tanisawa, K., Kifushi, M., Kogawa, M., et al. (2022) Dietary vitamin B1 intake influences gut microbial community and the consequent production of short-chain fatty acids. Nutrients, 14, 2078.
6) Chen, Y.-A., Park, J., Natsume-Kitatani, Y., Kawashima, H., Mohsen, A., Hosomi, K., Tanisawa, K., Ohno, H., Konishi, K., Murakami, H., et al. (2020) MANTA, an integrative database and analysis platform that relates microbiome and phenotypic data. PLoS One, 15, e0243609.
7) Mohsen, A., Park, J., Chen, Y.-A., Kawashima, H., & Mizuguchi, K. (2019) Impact of quality trimming on the efficiency of reads joining and diversity analysis of Illumina paired-end reads in the context of QIIME1 and QIIME2 microbiome analysis frameworks. BMC Bioinformatics, 20, 581.
8) Turnbaugh, P.J., Ley, R.E., Mahowald, M.A., Magrini, V., Mardis, E.R., & Gordon, J.I. (2006) An obesity-associated gut microbiome with increased capacity for energy harvest. Nature, 444, 1027–1031.
9) Qin, J., Li, Y., Cai, Z., Li, S., Zhu, J., Zhang, F., Liang, S., Zhang, W., Guan, Y., Shen, D., et al. (2012) A metagenome-wide association study of gut microbiota in type 2 diabetes. Nature, 490, 55–60.
10) Gurung, M., Li, Z., You, H., Rodrigues, R., Jump, D.B., Morgun, A., & Shulzhenko, N. (2020) Role of gut microbiota in type 2 diabetes pathophysiology. EBioMedicine, 51, 102590.
11) Everard, A., Belzer, C., Geurts, L., Ouwerkerk, J.P., Druart, C., Bindels, L.B., Guiot, Y., Derrien, M., Muccioli, G.G., Delzenne, N.M., et al. (2013) Cross-talk between Akkermansia muciniphila and intestinal epithelium controls diet-induced obesity. Proc. Natl. Acad. Sci. USA, 110, 9066–9071.
12) Cani, P.D. & de Vos, W.M. (2017) Next-generation beneficial microbes: The case of Akkermansia muciniphila. Front. Microbiol., 8, 1765.
13) Depommier, C., Everard, A., Druart, C., Plovier, H., Van Hul, M., Vieira-Silva, S., Falony, G., Raes, J., Maiter, D., Delzenne, N.M., et al. (2019) Supplementation with Akkermansia muciniphila in overweight and obese human volunteers: A proof-of-concept exploratory study. Nat. Med., 25, 1096–1103.
14) Hosomi, K., Saito, M., Park, J., Murakami, H., Shibata, N., Ando, M., Nagatake, T., Konishi, K., Ohno, H., Tanisawa, K., et al. (2022) Oral administration of Blautia wexlerae ameliorates obesity and type 2 diabetes via metabolic remodeling of the gut microbiota. Nat. Commun., 13, 4477.
15) Ozato, N., Saito, S., Yamaguchi, T., Katashima, M., Tokuda, I., Sawada, K., Katsuragi, Y., Kakuta, M., Imoto, S., Ihara, K., et al. (2019) Blautia genus associated with visceral fat accumulation in adults 20–76 years of age. NPJ Biofilms Microbiomes, 5, 28.
16) Kunisawa, J., Arita, M., Hayasaka, T., Harada, T., Iwamoto, R., Nagasawa, R., Shikata, S., Nagatake, T., Suzuki, H., Hashimoto, E., et al. (2015) Dietary ω3 fatty acid exerts anti-allergic effect through the conversion to 17,18-epoxyeicosatetraenoic acid in the gut. Sci. Rep., 5, 9750.
17) Sawane, K., Nagatake, T., Hosomi, K., Hirata, S.I., Adachi, J., Abe, Y., Isoyama, J., Suzuki, H., Matsunaga, A., Fukumitsu, S., et al. (2019) Dietary omega-3 fatty acid dampens allergic rhinitis via eosinophilic production of the anti-allergic lipid mediator 15-hydroxyeicosapentaenoic acid in mice. Nutrients, 11, E2868.
18) Saika, A., Nagatake, T., Hirata, S.I., Sawane, K., Adachi, J., Abe, Y., Isoyama, J., Morimoto, S., Node, E., Tiwari, P., et al. (2021) ω3 fatty acid metabolite, 12-hydroxyeicosapentaenoic acid, alleviates contact hypersensitivity by downregulation of CXCL1 and CXCL2 gene expression in keratinocytes via retinoid X receptor α. FASEB J., 35, e21354.
19) Nagatake, T., Kishino, S., Urano, E., Murakami, H., Kitamura, N., Konishi, K., Ohno, H., Tiwari, P., Morimoto, S., Node, E., et al. (2022) Intestinal microbe-dependent ω3 lipid metabolite αKetoA prevents inflammatory diseases in mice and cynomolgus macaques. Mucosal Immunol., 15, 289–300.
20) Hosomi, K., Kiyono, H., & Kunisawa, J. (2020) Fatty acid metabolism in the host and commensal bacteria for the control of intestinal immune responses and diseases. Gut Microbes, 11, 276–284.
21) Maruyama, S., Matsuoka, T., Hosomi, K., Park, J., Nishimura, M., Murakami, H., Konishi, K., Miyachi, M., Kawashima, H., Mizuguchi, K., et al. (2022) Classification of the occurrence of dyslipidemia based on gut bacteria related to barley intake. Front. Nutr., 9, 812469.
22) Sawane, K., Hosomi, K., Park, J., Ookoshi, K., Nanri, H., Nakagata, T., Chen, Y.A., Mohsen, A., Kawashima, H., Mizuguchi, K., et al. (2022) Identification of human gut microbiome associated with enterolignan production. Microorganisms, 10, 2169.
著者紹介Author Profile
 細見 晃司(ほそみ こうじ)
細見 晃司(ほそみ こうじ)国立研究開発法人医薬基盤・健康・栄養研究所ヘルス・メディカル微生物研究センター 主任研究員.博士(獣医学).
略歴2015年に大阪府立大学大学院で学位を取得後,日本学術振興会特別研究員PDなどを経て現職.
研究テーマと抱負微生物と宿主の相互作用の解明を研究テーマに,微生物の視点から腸内細菌の役割や機能を明らかにし,基礎学術的知見の創出と有用菌の利活用につなげたいと考えている.
ウェブサイトhttps://www.nibiohn.go.jp/vaccine_material_project/
趣味子供と遊ぶこと.
 國澤 純(くにさわ じゅん)
國澤 純(くにさわ じゅん)国立研究開発法人医薬基盤・健康・栄養研究所ヘルス・メディカル微生物研究センター センター長.博士(薬学).
略歴2001年に大阪大学大学院で学位を取得後,日本学術振興会特別研究員(大阪大学,カリフォルニア大学バークレー校)や東京大学医科学研究所の准教授などを経て現職.
研究テーマと抱負病原微生物や共生微生物に焦点をあて,ワクチンやマイクロバイオーム創薬,ヘルスケアなど,社会実装につながる研究を進めている.
ウェブサイトhttps://www.nibiohn.go.jp/vaccine_material_project/
趣味読書.