メタボローム技術の進化に伴い,ヒトにおける多様な代謝物の存在が明らかになるとともに,その存在量に個人差があることが見いだされてきている.この代謝物プロフィールの違いが,健康状態,疾患状態の個人差に影響を与えている可能性が示唆されている.また,食品機能や薬効発現の個人差も,このような代謝物プロフィールの差異,さらには,それらをもたらす代謝活性の差異に大きな影響を受けていると考えられるようになってきた.
食事成分や薬効成分の代謝に関して,大きく二つの代謝系が関与する.一つはヒトそのものの代謝であり,その活性には個人差があることが報告されている.たとえば,薬物代謝の主要酵素であるP450モノオキシゲナーゼにおいて,さまざまな遺伝子多型が報告されている.もう一つの主要な代謝系が腸内細菌の代謝であり,腸内細菌叢が個人により異なることから想定されるように,やはり個人差が存在する.したがって,食品機能や薬効発現に個人差を与える腸内細菌の代謝活性,代謝物プロフィールの調整が腸内デザインの一つの方向性であると考えられる.
こういった腸内デザインを深化させ,デザインを具現化するツールを開発するために重要な要素の一つが,腸内細菌における食事成分・薬効成分代謝の理解である.食品は生物材料に由来するため,代表的な生体構成高分子である,糖質,脂質,タンパク質,核酸を含む.これらの成分はヒトの消化酵素により低分子化され,それぞれ,オリゴ糖・単糖,アシルグリセロール・脂肪酸,ペプチド・アミノ酸,ヌクレオシド・核酸塩基などに低分子化され小腸で吸収される.そして同時に,小腸に存在する腸内細菌によりさまざまな代謝変換を受ける.また,植物由来の漢方薬には,健康効果を惹起する化学物質(ファイトケミカル)が植物機能性分子として含まれる.これらの化合物も小腸に存在する腸内細菌により脱グリコシル化などの変換を受け,生物活性や吸収性が変化する.さらに,小腸で吸収されずに大腸にまで達した化合物の一部は,大腸に存在する多様な腸内細菌群によりさまざまに代謝されるとともに,短鎖脂肪酸などの発酵産物の基質となる.
本稿では,腸内細菌における食事成分・薬効成分の代謝解析研究の例として,植物機能性分子の腸内細菌代謝,ならびに,食事成分の腸内細菌代謝の解析例を紹介する.また,新たに見いだされた腸内細菌代謝物の生理機能解析とそれらの応用を,代謝物ならびに菌叢レベルでの腸内デザインの一例として紹介する.
1)フラボノイド配糖体代謝
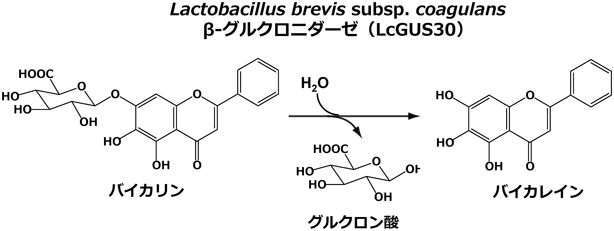
フラボノイドなどの植物の二次代謝物には生理活性成分が多数存在し,それらの多くは配糖体として蓄積されている.バイカリン(baicalein 7-O-β-D-glucuronide)は特定のシソ科植物で生産されるフラボノイドグルクロン酸配糖体であり,生薬成分としてよく知られている(図1).その生理活性は,腸内細菌の糖質分解酵素β-グルクロニダーゼによる加水分解を受け発揮されるため,腸内細菌叢に依存する.一方で,腸内細菌のβ-グルクロニダーゼは体内の薬物代謝に密接に関係しており,グルクロン酸修飾により一度不活性化された脂溶性生理活性物質を腸内でもう一度活性化させ,体内に蓄積させてしまう腸肝循環の原因を担う酵素として知られている.よって,β-グルクロニダーゼ活性を有するプロバイオティクスを,そのままバイカリンの生理機能発現のために利用する際には腸肝循環も考慮する必要があると考えられる.筆者らは植物由来のフラボノイド配糖体に選択性を示すLactobacillus brevis subsp. coagulans由来のバイカリン変換酵素(LcGUS30)を同定し(図1),腸内でのフラボノイド配糖体代謝酵素としての機能を解明した1).
LcGUS30は分子量60,000のGH30(アミノ酸配列の相同性に基づいた糖質分解酵素の分類群)に属する酵素であった.既存のβ-グルクロニダーゼは,他の分類群GH1, 2, 79にしか存在しておらず,LcGUS30とも非常に低い相同性を示したことから,LcGUS30は新規性の高いβ-グルクロニダーゼであることが示された.さらに,糖に対しては厳密な基質特異性を示すが,アグリコンに対しては広い基質特異性を有することが示された.くわえて,漢方薬の配糖体成分として存在するワゴノシドに対しても変換活性を示したことから,LcGUS30がバイカリンならびにワゴノシド変換酵素として有効であることが示された.一方,体内ステロイドホルモンであるエストロン3-β-D-グルクロニドなどのヒト由来天然基質に対する親和性が低く,植物由来フラボノイド配糖体であるバイカリンを基質として好むことが示された.これにより,LcGUS30は,腸肝循環に影響を及ぼす代表的な腸内細菌である大腸菌由来のβ-グルクロニダーゼとは異なる基質特異性を有することが示された1).よって,L. brevis subsp. coagulansは腸肝循環に影響を与えず,経口摂取されたフラボノイドグルクロン酸配糖体に効率的に作用する,生薬の機能性向上に有用なプロバイオティクス候補である可能性が示された.
2)グルコシノレート代謝
ブロッコリー等のアブラナ科植物にはS-グリコシド結合型配糖体の一種であるグルコシノレートが含まれる.グルコシノレートはヒト自身の保有する酵素では分解されず,腸内細菌の働きにより分解されてイソチオシアネートに変換される.イソチオシアネートは抗がん,抗酸化,抗炎症などさまざまな生理機能を示すが,グルコシノレートは生理機能を示さないため,得られる生理機能は腸内細菌叢のグルコシノレート分解活性に依存する.
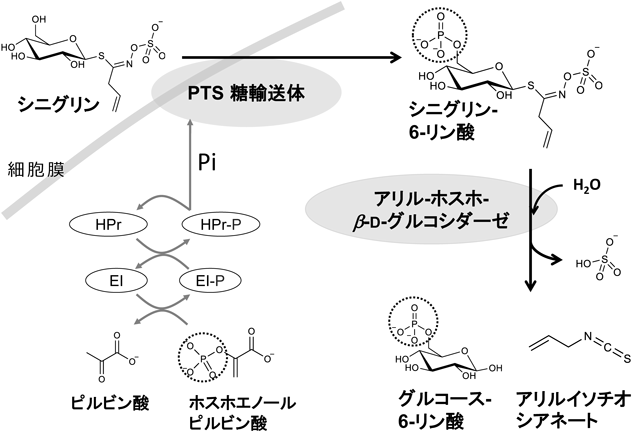
グルコシノレートの一種であるシニグリンを分解する乳酸菌を探索し,Companilactobacillus farciminis KB1089を得た.本菌のシニグリン分解活性は,培地中のグルコースが枯渇した後にシニグリンによって誘導された.活性誘導・非誘導それぞれの条件下で培養した菌体内のタンパク質を抽出し,ペプチドに断片化して網羅的解析を行った結果,誘導菌体内で特異的に発現するタンパク質群を同定した.それらタンパク質の中でシニグリン分解への直接的な関与が考えられるものとして,PTS糖輸送体(phosphoenolpyruvate:sugar phosphotransferase system)とアリル-ホスホ-β-D-グルコシダーゼに注目した(図2).これらの遺伝子それぞれについて,大腸菌,乳酸菌などさまざまな宿主を用いた発現系を構築し機能解析を試みたところ,乳酸菌Lactococcus lactis NZ9000を宿主としたアリル-ホスホ-β-D-グルコシダーゼ発現株において,アリルイソチオシアネート産生活性の増加傾向が観察された.また,同宿主のPTS糖輸送体発現株においては,シニグリン分解活性とアリルイソチオシアネート産生活性の顕著な増加が観察された2).
以上のことから,腸内細菌におけるグルコシノレート代謝が,PTS糖輸送体,アリル-ホスホ-β-D-グルコシダーゼが関与する,リン酸化を伴う取り込みと細胞内でのリン酸化糖分解により構成されていることが明らかとなった(図2).今後,本知見に着目したグルコシノレート分解腸内細菌の選抜と,そのプロバイオティクスとしての活用を通して,アブラナ科植物の生理機能を向上しうる新たなツールの開発が期待される.
3)ポリフェノール代謝
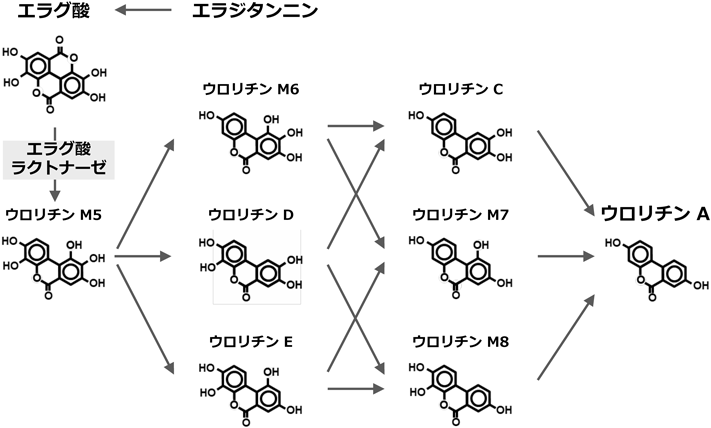
ポリフェノール化合物の一種であるウロリチンは,ザクロやイチゴなどのベリー類,クルミなどのナッツ類に含まれているエラジタンニンに由来する化合物である.腸内細菌によりエラジタンニンがエラグ酸,さらにウロリチン類へと代謝されることが報告されている(図3).ウロリチン類の中でもウロリチンAやウロリチンBは抗酸化・抗炎症作用といった生理活性を示すことから健康増進への寄与が期待されている.腸内でのウロリチン産生はエラグ酸の分子内ラクトンの加水分解を初発反応としており,加水分解により生じるウロリチンM5を起点としてさまざまなウロリチンが産生される.
ヒト便由来腸内細菌Gordonibacter urolithinfaciens DSM 27213はエラグ酸をウロリチンM5へと変換し,さらにウロリチンM5をウロリチンM6,ウロリチンCへと変換することが報告されている3).
本菌を,エラグ酸添加培地と非添加培地にて培養し,それぞれの条件でのエラグ酸変換活性を比較した.その結果,エラグ酸添加培地にて培養した菌体でのみエラグ酸変換活性を確認した.これより,本菌のエラグ酸変換酵素はエラグ酸添加培地で培養することにより誘導される酵素であることが明らかとなった.次に,エラグ酸変換活性の初発反応に関与する酵素を特定するために,プロテオーム解析により誘導菌体と非誘導菌体でのタンパク質の発現を比較したところ,誘導菌体で高発現している加水分解酵素と予想されるタンパク質(UroH)を見いだした.大腸菌を宿主とするUroHの異種タンパク質発現系を構築し活性評価を行うことで,UroHがエラグ酸からウロリチンM5への加水分解反応を触媒する新規酵素(エラグ酸ラクトナーゼ)であることが明らかとなった4).
4)サポニン配糖体代謝
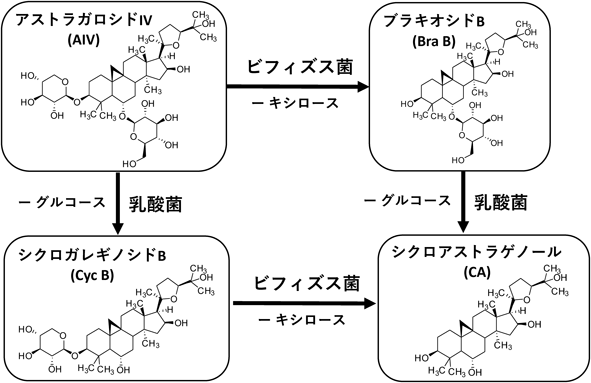
アストラガロシドIV(AIV)は,黄耆(オウギ)由来のサポニンであり,漢方薬として多くの研究がなされている.AIVのアグリコンであるシクロアストラゲノール(CA)は,テロメラーゼ活性化剤であり,テロメアの短縮を防止することで加齢や病気の進行を遅らせうる.また,抗炎症作用により創傷治癒を改善するなど,多くの有益な生理作用を有しているため,医薬品業界での需要が高い.
ヒトの腸内細菌を対象とした解析の結果,AIVからCAへの代謝に関して,ビフィズス菌と乳酸菌がそれぞれ異なる経路を有することを見いだした.すなわち,ビフィズス菌ではC-3キシロースの脱グリコシル化を初発反応として中間体ブラキオシドB(BraB)を経る経路が主であり,乳酸菌ではC-6グルコースの脱グリコシル化を初発反応として中間体シクロガレギノシドB(CycB)を経る経路が主であることを見いだした(図4)5).また,乳酸菌とビフィズス菌のそれぞれの脱グリコシル化活性を組み合わせCAを生成する2段階反応法を構築し,AIVからの効率的CA生産を可能とした5).
1)アミノ酸代謝
a.アミノ酸のラセミ化
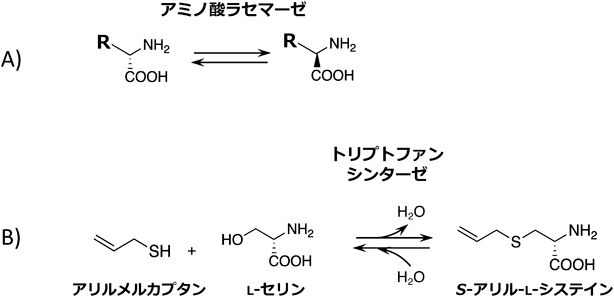
D-アミノ酸は天然には希少なアミノ酸であり,細菌のペプチドグリカンや微生物の産生する抗生物質等に含まれるにすぎないと考えられてきた.しかし近年,分析技術の発展により,ヒトを含む高等生物体内にも複数の遊離型D-アミノ酸が存在していることが明らかとなった.最近,遊離型D-アミノ酸が腸管内にも存在し,宿主のD-アミノ酸酸化酵素の発現への影響を介して腸内細菌叢を制御している可能性が見いだされてきている6).たとえば,D-アミノ酸酸化酵素はビブリオ属細菌の作るD-メチオニンに作用することで過酸化水素を発生し,ビブリオ属細菌に対して殺菌力を発揮する.また,栄養要求性が強い乳酸菌などの腸内共生菌は,D-アミノ酸が存在すると生育が向上するものもある.たとえば,Pediococcus pentosaceusにおいてD-ロイシンの添加による対数増殖開始の遅延と定常期における菌体数の上昇を認めている7).したがって,D-アミノ酸によるD-アミノ酸酸化酵素の発現向上が,結果的に腸管内のD-アミノ酸の分布と濃度を変化させ,腸内細菌叢の推移に影響を与えうると考えられる.
筆者らはこのD-アミノ酸の生理機能をプロバイオティクスを介して制御すべく,L-アミノ酸からD-アミノ酸へのラセミ化能を有する乳酸菌を探索した(図5A).その結果,複数のアミノ酸に対しラセミ化能を有する乳酸菌を多数見いだした.すべての菌において,反応がピリドキサールリン酸に依存的であり,アミノ酸ラセマーゼによる一段階のラセミ化反応である可能性が示唆された8).これらのアミノ酸ラセミ化活性を有する乳酸菌を用い,食品由来のアミノ酸とのコンビネーションにより腸内細菌叢を制御しうる,新たな応用の方向性が示された.
b.含硫アミノ酸代謝
S-アリル-L-システイン(SAC)は,疲労感低減効果,神経保護作用,睡眠改善効果などを有するアミノ酸である.長期熟成ニンニク(黒ニンニク)に見いだされる希少な素材であり,抗酸化活性によるアンチエイジング効果なども期待されている.そこで,SACを合成可能な腸内細菌の取得を目指した.筆者らは,SAC類縁体の合成実績のあるトリプトファンシンターゼに着目した.微生物をL-トリプトファンを含まない低栄養な培地で培養することで,トリプトファンシンターゼ活性が顕在化することを見いだすとともに,顕在化菌体がL-セリンとアリルメルカプタン(食品用香料)を基質にSACを合成しうることを確認した(図5B).この結果を踏まえ,低栄養な半合成培地を用いたSAC合成腸内細菌のスクリーニング法を構築するとともに,SACを合成する腸内細菌を見いだすことに成功した.選抜した腸内細菌やその酵素を用いることで,希少な生理活性アミノ酸であるSACの合成が可能となる.これらの菌はさまざまなS-置換システインの合成にも応用可能であり,多様な含硫アミノ酸関連の機能性分子の誘導も期待できる9).
2)核酸代謝
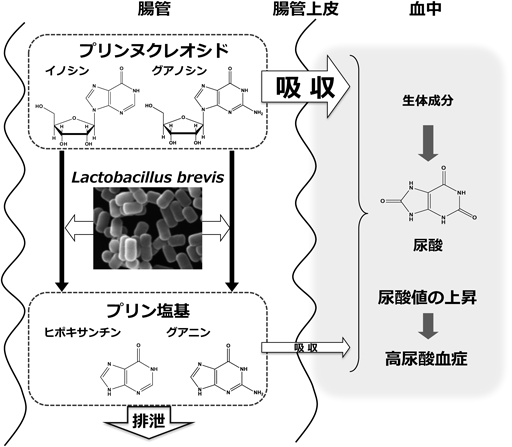
消化管内で乳酸菌がプリン体を分解することができれば,体内へのプリン体の吸収を抑制でき,血中尿酸値を低減できると考えられた.ヒト腸管におけるプリン体代謝の律速段階はプリンヌクレオシドであるイノシン,アデノシン,グアノシンの分解であると想定されている.また,プリンヌクレオシドは,その代謝物質であるプリン塩基に比べて血中尿酸値の上昇を招きやすい.そこで,乳酸菌におけるプリンヌクレオシド分解活性を評価した(図6).その結果,プリンヌクレオシドを活発に分解する菌株としてLactobacillus brevis, Lactobacillus pentosus, Lactobacillus fermentum,などが選抜され,食餌性高尿酸血症モデルラットを用いた血中尿酸値上昇抑制効果が検討された.対照群の血中尿酸値が経時的に上昇したのに対し,乳酸菌投与は血中尿酸値の上昇抑制傾向を示した.モデルラットでの検討のみならず,ヒトでの試験も試みられ,血中尿酸値が高値の者に対して有効性を示す結果が得られている.
以上の結果により,乳酸菌を,高尿酸血症予防効果が期待できるプロバイオティクスとして利用できる可能性が示された.最近では,代謝活性を維持した状態で乳酸菌を腸まで届ける技術として,カカオ油脂などの食品油脂で乳酸菌をコーティングする技術も開発されている.本処理技術により,プリンヌクレオシド代謝活性が効率的に保持されることが示されている10, 11).
3)脂肪酸代謝
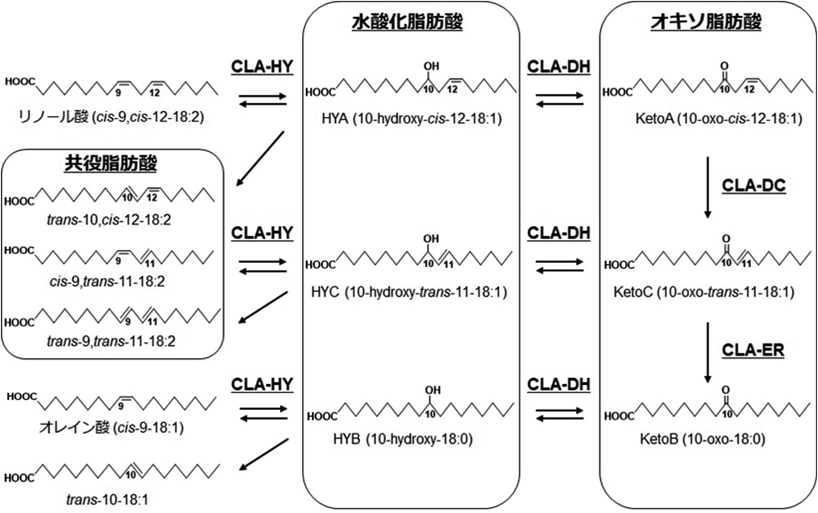
筆者らは,食事脂質に由来する不飽和脂肪酸が,腸内細菌により飽和化される新規な脂肪酸飽和化代謝を見いだし,水酸化・オキソ・エノン脂肪酸,部分飽和脂肪酸,共役脂肪酸を代謝物として同定した12, 13).図7に腸内細菌の一種であるLactobacillus plantarumをモデルに解明されたリノール酸の飽和化代謝を示す.この飽和化代謝は,炭素数18の遊離脂肪酸に対して特異的な,Δ9位の二重結合への水和反応によるC10水酸化脂肪酸の生成を起点とする代謝であったが,腸内細菌に幅広く飽和化代謝を探索することにより,さまざまな不飽和脂肪酸変換反応を見いだすことができた.
たとえば,Lactobacillus acidophilus NTV001株は,炭素数18の脂肪酸に対してΔ12位の二重結合への水和反応によるC13水酸化脂肪酸の生成を起点とする代謝とともに,アラキドン酸(C15水酸化体を生成),ジホモ-γ-リノレン酸(C12ならびにC15水酸化体を生成)などの炭素数20の脂肪酸,さらには,炭素数22のドコサヘキサエン酸(DHA)(C14水酸化体を生成)にも作用した14).
また,Clostridium bifermentansは,エイコサペンタエン酸(EPA),DHAといったω3脂肪酸を飽和化し,二重結合の数が一つ減少したユニークな部分飽和脂肪酸を生成した.くわえて,本代謝中間体としてω3脂肪酸に由来する共役脂肪酸の生成が観察された15).
食事脂質代謝物として見いだされたこれらの水酸化・オキソ・エノン脂肪酸,部分飽和脂肪酸,共役脂肪酸の宿主における存在とその由来を確認すべく,specific pathogen-free(SPF)マウスと無菌(germ-free:GF)マウスを通常飼料を用いて飼育し,結腸,小腸,血漿における脂肪酸を分析した.その結果,リノール酸およびオレイン酸の腸内細菌による初期代謝物である水酸化脂肪酸10-hydroxy-cis-12-octadecenoic acid(HYA)と13-hydroxy-cis-9-octadecenoic acidおよび10-hydroxy-octadecenoic acidなどの代謝物が各種組織中に確認された.さらに確認されたこれらの代謝物の量はSPFマウスにおいてGFマウスよりも顕著に多かったことから,これらの脂肪酸が腸内細菌の存在に依存して生成していることが示唆された12).
食事成分・薬効成分の腸内細菌代謝の理解に関して,二つの活用の方向性が想定される.第一は,診断への活用である.代謝に関連する腸内細菌遺伝子配列情報の活用であり,個々人の腸内細菌叢のメタゲノム情報における代謝遺伝子の有無により,食事成分・薬効成分由来代謝物に起因する生理活性の享受の程度が理解されうる.第二は,栄養・健康状態の改善に関する活用であり,これには,代謝活性菌をプロバイオティクスとして摂取することで代謝物の発生を促す方法論と,代謝物そのものを摂取することで代謝物に起因する生理活性を享受しようとする方法論が想定される.特に後者において活用される食事成分の腸内細菌代謝物はポストバイオティクスと定義され,その活用の展開が図られている.ここでは,これらの活用に資する,腸内細菌における食事成分代謝物,特に,脂肪酸代謝物の生理機能解析研究を俯瞰するとともに,腸内細菌代謝物のポストバイオティクスとしての応用例を紹介したい.
1)腸内細菌の脂肪酸代謝物の生理機能
食事由来脂肪酸が腸内細菌により飽和化されること,代謝物として水酸化・オキソ・エノン脂肪酸などが生成し(図7),宿主に移行していることを見いだした12, 13).これらの代謝物の生理機能を解析した結果,その基質である食事由来の脂肪酸にはみられない機能,代謝物によっては,食事由来脂肪酸に報告される機能とは逆の機能を示すことが明らかとなった.たとえば,ω6脂肪酸であるリノール酸はヒトの代謝によりアラキドン酸へ変換され炎症性メディエーターの基質となるが,リノール酸由来の腸内細菌代謝物であるHYAについては,Th1/Th2バランスを改善しアトピー性皮膚炎様症状の悪化を抑えることを,マウスを用いた実験において報告している16).また,HYAがGPR40を起点とするシグナル伝達を介して,腸管上皮や歯肉上皮のバリア機能の低下を抑制すること見いだしている17, 18).くわえて,HYAには,ペルオキシソームのβ酸化促進作用19),ミクログリア細胞におけるERKの活性化を抑制することによる抗炎症作用や20),抗ヘリコバクター活性21)を見いだしている.また,リノール酸由来のオキソ脂肪酸にTRPV1を介した脂質代謝・エネルギー代謝制御機能22)を見いだしている.さらに,ω6脂肪酸であるγ-リノレン酸由来のエノン脂肪酸についても,リポ多糖(LPS)による骨髄由来マクロファージからのIL-6放出を抑制するなど,抗炎症活性を見いだしている23).γ-リノレン酸由来の水酸化脂肪酸,オキソ脂肪酸については,腸管オルガノイドを用いた検討により,PPARδリガンドとして機能し,ヒト腸内の脂質代謝を改善する可能性を示唆している24).一方,ω3脂肪酸であるα-リノレン酸由来の水酸化・オキソ脂肪酸についても,単球の抗炎症性M2型マクロファージへの分化に寄与し腸管をTh2サイトカイン優位な環境に制御すること25),マクロファージに作用してアレルギー性接触皮膚炎や糖尿病の病態形成を抑制することを動物モデルで明らかにしている26).α-リノレン酸由来のオキソ脂肪酸については,食欲関連消化管ホルモンであるコレシストキニンの放出を介した胃排出促進も報告している27).この他にも,リノール酸,α-リノレン酸,γ-リノレン酸由来のエノン脂肪酸に抗酸化作用28, 29),抗炎症作用30),抗菌作用31),や非アルコール性脂肪肝炎の進行抑制効果を32)を見いだしている.これらの知見は,食事脂質の脂肪酸組成と腸内細菌の脂肪酸代謝活性の相互作用が,代謝物の生理機能を介して健康維持において重要な意味を持つことを示している33, 34).これまで想定されてきた食事脂質の健康機能の全体像が,腸内細菌代謝物の生理機能を考慮することにより,大きく刷新されると考えられる.
2)食事成分の腸内細菌代謝物「ポストバイオティクス」の応用
食事成分の腸内細菌代謝物はポストバイオティクスと呼ばれ,腸内細菌機能の実行分子である可能性が示唆されている.食事成分に由来するポストバイオティクスは,健康時に体内で生成している化合物であることから安全性が高いことが想定され,機能性食品素材や医薬品素材として注目されている.
筆者らが食事由来脂肪酸の腸内細菌代謝物として見いだしたリノール酸由来の水酸化脂肪酸であるHYAについて,その長期投与がマウスへの高脂肪食投与による血糖値上昇傾向を抑制することを見いだしている35).くわえて,HYAの長期投与は,腸内細菌叢にも変化を促し,抗肥満・抗糖尿病効果が期待される代謝物の生産が顕著なLactobacillaceae科の増加をもたらすことを見いだした35).HYAについては,ヒトに対する効果,安全性も検証されている36–38).HYAは乳酸菌代謝を利用して植物油脂から作ることができ,乳酸発酵食品にも少量含まれているため食経験もある安心かつ安全な素材であることから,サプリメント素材としての開発が進められ,市販されるに至っている.今後,最新の分析技術39)により見いだされるさまざまな食事脂質由来代謝物についても,生理機能解析を介したポストバイオティクスとしての開発が期待されている.
本稿で述べた植物由来機能性成分の腸内細菌代謝,たとえば,機能性配糖体からのアグリコン生成や1, 2),ポリフェノール類の代謝変換3, 4)においても,特異な代謝物が認められる.たとえば,ザクロなどに含まれるポリフェノールであるエラグ酸から,腸内細菌に特異的な嫌気的還元反応である脱水酸化反応により,ウロリチン類が生成する.ウロリチン類に関しては,オートファジー活性化などの生理機能が報告されている.また,代表的な食事成分であるタンパク質に由来するアミノ酸に関しても,上述したD-アミノ酸へのラセミ化に加え,グルタミン酸に由来し降圧作用,抗不安作用等のさまざまな生理機能を示すγ-アミノ酪酸(GABA)のトマト成分からの生成について報告している40).くわえて,チロシンからの抗肥満作用が報告されているクレゾール41)の産生についても検討を行っている.これらの腸内細菌に特異な代謝に由来する代謝物についても,ポストバイオティクスとしての応用が期待される.
生活習慣病関連疾患では,腸内細菌叢の変化が報告されており,疾患を理解する主なパラメータとして腸内細菌叢と疾患症状が取り上げられている.これまで,この二つのパラメータを同時に制御しうるツールはなく,症状緩和にのみ対応し腸内フローラに悪影響を及ぼす抗生物質などの薬剤,ならびに,菌叢変化のみに対応するプロバイオティクス等が開発されてきた.今後,これら二つのパラメータを同時に制御しうる化合物(デュアルコントローラ)が必要であると考えられており42),食事成分の腸内細菌代謝物であるポストバイオティクスは,デュアルコントローラとしても有望な候補であると考えられる.
腸内細菌研究は,ゲノム科学の進展により菌株の単離同定を主とした解析から,菌叢の俯瞰的解析へと大きく転換した.今後,一細胞レベルでのゲノム解析や,膨大な分子・代謝物を対象とするメタボロミクス解析などのオミクス解析,くわえて,健康状態や疾患と腸内細菌叢・食事・腸内細菌代謝物との関連性を読み解くコホート研究などの情報科学により,腸内細菌と健康・疾患に関する知見はさらに深化すると考えられる.
本稿で述べた,食事成分・薬効成分の腸内細菌代謝の理解は,健康維持のための腸内デザインに資する情報を提供する.たとえば,代謝系に関与する酵素の遺伝子情報と腸管メタゲノム情報の活用により,個々人の腸内細菌叢における代謝物産生能の有無,ひいては,食事成分の潜在機能の享受の程度が理解され,腸内デザインへの有用な指針を提供する.また,食事成分の腸内細菌代謝物(ポストバイオティクス)や特異な代謝活性を有する微生物(プロバイオティクス)が,食品機能や薬効の顕在化ツールとして,さらには,食事成分の機能発現における個人差を調整する腸内デザインの具現化ツールとして開発されうる.このような状況は,腸内細菌研究を起点とした新たな健康・医療技術ならびに関連産業の胎動をうながしている.ヒトを腸内細菌などの常在菌も含めた超生命体として理解し,食事成分や薬効成分の腸内細菌代謝物を最新のオミクス技術で解析することで,これらの潮流が加速されると思われる.
謝辞Acknowledgments
代謝解析では,著者研究室に所属された櫻間晴子博士,渡邊寛子博士,Daniel Makoto Takeuchi博士,現員の岡田奈津実博士,水谷拓氏,慶応大学薬学部・有田誠教授に,生理機能解析では,広島大学生物圏科学研究科・田辺創一教授(現・江崎グリコ株式会社)ならびに鈴木卓弥教授,新潟大学医歯学総合研究科・山崎和久教授(現・理化学研究所),徳島大学生物資源産業学部・田中保教授,富山大学薬学部・久米利明教授,北里大学北里生命科学研究所・松井英則講師,京都大学農学研究科・河田照雄名誉教授,菅原達也教授ならびに後藤剛准教授,東京理科大学先進工学部・西山千春教授,東京大学農学生命研究科・佐藤隆一郎教授,医薬基盤・健康・栄養研究所・國澤純プロジェクトリーダー,北海道大学農学研究科・原博教授(現・藤女子大学),東京農工大学・宮本潤基准教授,京都大学生命科学研究科・木村郁夫教授,Noster株式会社・米島靖記博士にご尽力いただきましたことに御礼申し上げます.本研究の一部は,生研センターイノベーション創出基礎的研究推進事業・農林水産業食品産業科学技術研究推進事業,先端的低炭素化技術開発(ALCA),官民研究開発投資拡大プログラム(PRISM),日本医療研究開発機構(AMED),新エネルギー・産業技術総合開発機構(NEDO)の支援を受けました.
引用文献References
1) Sakurama, H., Kishino, S., Uchibori, Y., Yonejima, Y., Ashida, H., Kita, K., Takahashi, S., & Ogawa, J. (2014) β-Glucuronidase from Lactobacillus brevis useful for baicalin hydrolysis belongs to glycoside hydrolase family 30. Appl. Microbiol. Biotechnol., 98, 4021–4032.
2) Watanabe, H., Usami, R., Kishino, S., Osada, K., Aoki, Y., Morisaka, H., Takahashi, M., Izumi, Y., Bamba, T., Aoki, W., et al. (2021) Enzyme systems involved in glucosinolate metabolism in Companilactobacillus farciminis KB1089. Sci. Rep., 11, 23715.
3) Watanabe, H., Kishino, S., Kudoh, M., Yamamoto, H., & Ogawa, J. (2020) Evaluation of electron-transferring cofactor mediating enzyme systems involved in urolithin dehydroxylation in Gordonibacter urolithinfaciens DSM 27213. J. Biosci. Bioeng., 129, 552–557.
4) 岸野重信,渡邊寛子,熊澤加奈子,工藤眞丈,林素子,山本浩明,小川順(2020)Gordonibacter urolithinfaciens DSM27213における新規酵素エラグ酸ラクトナーゼの同定および機能解析.2020年度日本農芸化学会大会講演要旨,3A15a03.
5) Takeuchi, D.M., Kishino, S., Ozeki, Y., Fukami, H., & Ogawa, J. (2022) Analysis of astragaloside IV metabolism to cycloastragenol in human gut microorganism, bifidobacteria, and lactic acid bacteria. Biosci. Biotechnol. Biochem., 86, 1467–1475.
6) Sasabe, J., Miyoshi, Y., Rakoff-Nahoum, S., Zhang, T., Mita, M., Davis, B.M., Hamase, K., & Waldor, M.K. (2016) Interplay between microbial d-amino acids and host d-amino acid oxidase modifies murine mucosal defence and gut microbiota. Nat. Microbiol., 1, 16125.
7) 坂口貴之,岡田奈津実,竹内道樹,岸野重信,小川順(2016)乳酸菌の生育に対するD-アミノ酸の影響.2016年度日本農芸化学会大会講演要旨,2F209.
8) 森川拓磨,岡田奈津実,岸野重信,小川順(2018)アミノ酸ラセミ化能を有するヒト腸内細菌の探索.2018年度日本農芸化学会大会講演要旨,2A10p09.
9) Mizutani, T., Hara, R., Takeuchi, M., Yamagishi, K., Hirao, Y., Mori, K., Hibi, M., Ueda, M., & Ogawa, J. (2022) l-Tryptophan-starved cultivation enhances S-allyl-l-cysteine synthesis in various food-related microorganisms. Biosci. Biotechnol. Biochem., 86, 792–799.
10) Yonejima, Y., Hisa, K., Kawaguchi, M., Ashitani, H., Koyama, T., Usami-Krank, Y., Kishida, N., Kishino, S., & Ogawa, J. (2015) Lactic acid bacteria-containing chocolate as a practical probiotic product with increased acid tolerance. Biocatal. Agric. Biotechnol., 4, 773–777.
11) 米島靖記,久景子,松原由以(2017)チョコレートでとる乳酸菌:乳酸菌を腸で活躍させるために.化学と生物,56, 47–51.
12) Kishino, S., Takeuchi, M., Park, S.B., Hirata, A., Kitamura, N., Kunisawa, J., Kiyono, H., Iwamoto, R., Isobe, Y., Arita, M., et al. (2013) Polyunsaturated fatty acid saturation by gut lactic acid bacteria affecting host lipid composition. Proc. Natl. Acad. Sci. USA, 110, 17808–17813.
13) 小川順,岸野重信(2019)食と健康をつなぐ腸内細菌の脂肪酸代謝と代謝物の生理機能.生化学,91, 492–499.
14) Hirata, A., Kishino, S., Park, S.B., Takeuchi, M., Kitamura, N., & Ogawa, J. (2015) A novel unsaturated fatty acid hydratase toward C16 to C22 fatty acids from Lactobacillus acidophilus. J. Lipid Res., 56, 1340–1350.
15) Sakurama, H., Kishino, S., Mihara, K., Ando, A., Kita, K., Takahashi, S., Shimizu, S., & Ogawa, J. (2014) Biohydrogenation of C20 polyunsaturated fatty acids by anaerobic bacteria. J. Lipid Res., 55, 1855–1863.
16) Kaikiri, H., Miyamoto, J., Kawakami, T., Park, S.B., Kitamura, N., Kishino, S., Yonejima, Y., Hisa, K., Watanabe, J., Ogita, T., et al. (2017) Supplemental feeding of a gut microbial metabolite of linoleic acid, 10-hydroxy-cis-12-octadecenoic acid, alleviates spontaneous atopic dermatitis and modulates intestinal microbiota in NC/nga mice. Int. J. Food Sci. Nutr., 68, 941–951.
17) Miyamoto, J., Mizukure, T., Park, S.B., Kishino, S., Kimura, I., Hirano, K., Bergamo, P., Rossi, M., Suzuki, T., Arita, M., et al. (2015) A gut microbial metabolite of linoleic acid, 10-hydroxy-cis-12-octadecenoic acid, ameliorates intestinal epithelial barrier impairment partially via GPR40-MEK-ERK pathway. J. Biol. Chem., 290, 2902–2918.
18) Yamada, M., Takahashi, N., Matsuda, Y., Sato, K., Yokoji, M., Sulijaya, B., Maekawa, T., Ushiki, T., Mikami, Y., Hayatsu, M., et al. (2018) A bacterial metabolite ameliorates periodontal pathogen-induced gingival epithelial barrier disruption via GPR40 signaling. Sci. Rep., 8, 9008.
19) Morito, K., Shimizu, R., Kitamura, N., Park, S.B., Kishino, S., Ogawa, J., Fukuta, T., Kogure, K., & Tanaka, T. (2019) Gut microbial metabolites of linoleic acid are metabolized by accelerated peroxisomal β-oxidation in mammalian cells. BBA-Mol. Cell Biol. L, 1864, 1619–1628.
20) Ikeguchi, S., Izumi, Y., Kitamura, N., Kishino, S., Ogawa, J., Akaike, A., & Kume, T. (2018) Inhibitory effect of the gut microbial linoleic acid metabolites, 10-oxo-trans-11-octadecenoic acid and 10-hydroxy-cis-12-octadecenoic acid, on BV-2 microglial cell activation. J. Pharmacol. Sci., 138, 9–15.
21) Matsui, H., Takahashi, T., Murayama, S.Y., Kawaguchi, M., Matsuo, K., & Nakamura, M. (2017) Protective efficacy of a hydroxy fatty acid against gastric Helicobacter infections. Helicobacter, 22, e12430.
22) Kim, M., Furuzono, T., Yamakuni, K., Li, Y., Kim, Y.I., Takahashi, H., Ohue-Kitano, R., Jheng, H.F., Takahashi, N., Kano, Y., et al. (2017) 10-oxo-12(Z)-octadecenoic acid, a linoleic acid metabolite produced by gut lactic acid bacteria, enhances energy metabolism by activation of TRPV1. FASEB J., 31, 5036–5048.
23) Hagiwara, S., Nagata, K., Kasakura, K., Sakata, F., Kishino, S., Ogawa, J., Yashiro, T., & Nishiyama, C. (2020) The anti-inflammatory effect of the gut lactic acid bacteria-generated metabolite 10-oxo-cis-6,trans-11-octadecadienoic acid on monocytes. Biochem. Biophys. Res. Commun., 530, 342–347.
24) Noguchi, M., Shimizu, M., Lu, P., Takahashi, Y., Yamauchi, Y., Sato, S., Kiyono, H., Kishino, S., Ogawa, J., Nagata, K., et al. (2022) Lactic acid bacteria-derived γ-linolenic acid metabolites are PPARδ ligands that reduce lipid accumulation in human intestinal organoids. J. Biol. Chem., 298, 102534.
25) Ohue-Kitano, R., Yasuoka, Y., Goto, T., Kitamura, N., Park, S.B., Kishino, S., Kimura, I., Kasubuchi, M., Takahashi, H., Li, Y.J., et al. (2018) α-Linolenic acid-derived metabolites from gut lactic acid bacteria induce differentiation of anti-inflammatory M2 macrophages through G protein-coupled receptor 40. FASEB J., 32, 304–318.
26) Nagatake, T., Kishino, S., Urano, E., Murakami, H., Kitamura, N., Konishi, K., Ohno, H., Tiwari, P., Morimoto, S., Node, E., et al. (2022) Intestinal microbe-dependent ω3 lipid metabolite αKetoA prevents inflammatory diseases in mice and cynomolgus macaques. Mucosal Immunol., 15, 289–300.
27) Hira, T., Ogasawara, S., Yahagi, A., Kamachi, M., Li, J., Nishimura, S., Sakaino, M., Yamashita, T., Kishino, S., Ogawa, J., et al. (2018) Novel mechanism of fatty acid sensing in enteroendocrine cells: Specific structures in oxo-fatty acids produced by gut bacteria are responsible for CCK secretion in STC-1 cells via GPR40. Mol. Nutr. Food Res., 62, 1800146.
28) Furumoto, H., Nanthirudjanar, T., Kume, T., Izumi, Y., Park, S.B., Kitamura, N., Kishino, S., Ogawa, J., Hirata, T., & Sugawara, T. (2016) 10-oxo-trans-11-octadecenoic acid generated from linoleic acid by a gut lactic acid bacterium Lactobacillus plantarum is cytoprotective against oxidative stress. Toxicol. Appl. Pharmacol., 296, 1–9.
29) Yokoji-Takeuchi, M., Takahashi, N., Yamada-Hara, M., Sulijaya, B., Tsuzuno, T., Aoki-Nonaka, Y., Tabeta, K., Kishino, S., Ogawa, J., & Yamazaki, K. (2019) A bacterial metabolite induces Nrf2-mediated anti-oxidative responses in gingival epithelial cells by activating the MAPK signaling pathway. Arch. Oral Biol., 110, 104602.
30) Sulijaya, B., Takahashi, N., Yamada, M., Yokoji, M., Sato, K., Aoki-Nonaka, Y., Nakajima, T., Kishino, S., Ogawa, J., & Yamazaki, K. (2018) The anti-inflammatory effect of 10-oxo-trans-11-octadecenoic acid (KetoC) on RAW 264.7 cells stimulated with Porphyromonas gingivalis lipopolysaccharide. J. Periodontal Res., 53, 777–784.
31) Sulijaya, B., Yamada-Hara, M., Yokoji-Takeuchi, M., Matsuda-Matsukawa, Y., Yamazaki, K., Matsugishi, A., Tsuzuno, T., Sato, K., Aoki-Nonaka, Y., Takahashi, N., et al. (2019) Antimicrobial function of the polyunsaturated fatty acid KetoC in an experimental model of periodontitis. J. Periodontol., 90, 1470–1480.
32) Sofyana, N.T., Zheng, J., Manabe, Y., Yamamoto, Y., Kishino, S., Ogawa, J., & Sugawara, T. (2020) Gut microbial fatty acid metabolites (KetoA and KetoC) affect the progression of nonalcoholic steatohepatitis and reverse cholesterol transport metabolism in mouse model. Lipids, 55, 151–162.
33) 小川順(2022)改訂版もっとよくわかる腸内細菌叢(福田編),pp. 132–137,羊土社.
34) 岸野重信(2023)腸内細菌叢のユニークな脂肪酸代謝はどのように健康に寄与するのか.Microbiom. Sci., 2, 31–36
35) Miyamoto, J., Igarashi, M., Watanabe, K., Karaki, S., Mukouyama, H., Kishino, S., Li, X., Ichimura, A., Irie, J., Sugimoto, Y., et al. (2019) Gut microbiota confers host resistance to obesity by metabolizing dietary polyunsaturated fatty acids. Nat. Commun., 10, 4007.
36) Yonejima, Y., Urushihara, M., Kitao, K., & Furihata, K. (2017). Effects of the Intake of HYA-containing Food on Postprandial Hyperglycemia: a Randomized, Placebo-controlled, Doubleblind Crossover. Prog. Med., 37, 1105–1111.
37) Yonejima, Y., Urushihara, M., Kitao, K., & Furihata, K. (2019). Prog. Med., 39, 1147–1154.
38) Yonejima, Y., Yamada, K., & Takara, T. (2022). Prog. Med., 39, 887–893.
39) Tsuji, K., Shimada, W., Kishino, S., Ogawa, J., & Arita, M. (2022). Comprehensive analysis of fatty acid metabolites produced by gut microbiota using LC-MS/MS-based lipidomics. Med. Mass Spectrom., 6, 112–125.
40) Nakatani, Y., Fukaya, T., Kishino, S., & Ogawa, J. (2022) Production of GABA-enriched tomato juice by Lactiplantibacillus plantarum KB1253. J. Biosci. Bioeng., 134, 424–431.
41) Brial, F., Alzaid, F., Sonomura, K., Kamatani, Y., Meneyrol, K., Le Lay, A., Péan, N., Hedjazi, L., Sato, T., Venteclef, N., et al. (2018). The Natural Metabolite 4-Cresol Improves Glucose Homeostasis and Enhances β-Cell Function Cell Rep., 7, 2306–2320.
42) van de Guchte, M., Blottière, H.M., & Doré, J. (2018) Humans as holobionts: implications for prevention and therapy. Microbiome, 6, 81.
著者紹介Author Profile
 小川 順(おがわ じゅん)
小川 順(おがわ じゅん)京都大学大学院農学研究科応用生命科学専攻 教授.博士(農学).
略歴1967年滋賀県生まれ徳島県育ち.90年京都大学農学部農芸化学科卒業.95年同大学院農学研究科農芸化学専攻博士後期課程修了.2006~07年フランス国立農業研究所客員研究員.09年より現職.
研究テーマと抱負微生物に多様な機能を探索し,それを社会のために役立てる研究をしたい.
ウェブサイトhttp://www.hakko.kais.kyoto-u.ac.jp/
趣味クラシック音楽(オーボエ演奏・指揮),酒遊食楽.