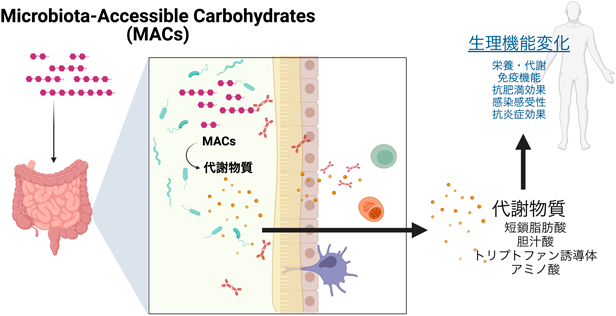
腸内細菌の組成や代謝に影響を与えるマイクロバイオームモジュレータMicrobiome-modulators affecting gut microbiota composition and metabolism
1 慶應義塾大学薬学部創薬研究センターResearch Center for Drug Discovery Faculty of Pharmacy, Keio University ◇ 〒105–8512 東京都港区芝公園1–5–30 ◇ 1–5–30 Shibakoen, Minato-ku, Tokyo 105–8512, Japan
2 慶應義塾大学先端生命科学研究所Institute for Advanced Biosciences, Keio University ◇ 〒997–0017 山形県鶴岡市大宝寺字日本国403–1 ◇ 403–1 Nipponkoku, Daihouji, Tsuruoka, Yamagata 997–0017, Japan
3 慶應義塾大学大学院政策・メディア研究科Systems Biology Program Graduate School of Media and Governance, Keio University ◇ 〒252–0882 神奈川県藤沢市遠藤5322 ◇ 5322 Endo, Fujisawa, Kanagawa 252–0882, Japan