我々の免疫系の約60%は腸管に集中しており,腸内細菌の刺激により恒常性が維持されている.実際,腸管内に菌をまったく保有しない無菌マウスでは免疫系が未熟であり,病原性細菌に対する抵抗性が低い.また,恒常性破綻による過剰な免疫応答は,炎症性腸疾患などの疾患につながる.
近年の研究から,菌体成分を感知するToll様受容体や細胞内受容体だけでなく,腸内細菌が産生する代謝物質もT細胞の分化をはじめとし,他の免疫細胞の機能に影響を及ぼすことが明らかになってきた.腸内細菌叢の乱れは腸管代謝物質の変動を来し,免疫系の異常,さらには疾患リスクの増加にもつながると考えられる.このように,腸内細菌叢–宿主間相互作用において腸内代謝物質を介した免疫系の修飾は重要な役割を果たしている.本稿では,腸内細菌が産生する代表的な代謝物質について,それらの免疫系修飾作用を概説する.
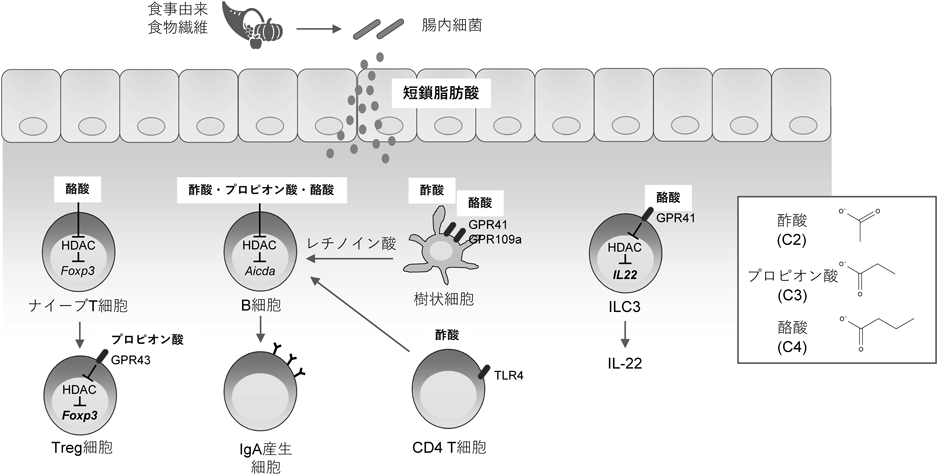
腸内細菌は我々が消化・吸収できない多糖を資化することでエネルギーを獲得している.ヒトのゲノムには食事由来糖鎖を消化するための酵素が17種類しかコードされておらず1),その対象はデンプン,スクロース,およびラクトースである.一方,腸内細菌は多様な消化酵素を保持しており,たとえばBacteroides thetaiotaomicronのゲノムには約260種類もの加水分解酵素がコードされている2).腸内細菌は宿主が消化できない食物繊維類を資化し,結果として短鎖脂肪酸を産生する.短鎖脂肪酸産生能は菌によって大きく異なるが,一般的に,Bacteroidota門に属する菌は酢酸を,Bacillota門に属する菌はプロピオン酸と酪酸を産生する.腸管においてはこれら短鎖脂肪酸が高濃度で存在しており,腸管上皮細胞のエネルギー源になるとともに,ヒストン脱アセチル化酵素(histone deacetylase:HDAC)の阻害物質として遺伝子発現のエピジェネティックな制御に寄与している.短鎖脂肪酸は宿主細胞表面に発現するGタンパク質共役型受容体(G-protein-coupled receptors:GPCRs)を活性化する.GPR41は主にプロピオン酸と酪酸,GPR43は酢酸とプロピオン酸によって活性化される3).また,GPR109aも酪酸によって活性化される4).
1)T細胞への作用
短鎖脂肪酸はT細胞の分化や増殖に大きく影響を及ぼす.酪酸化デンプンを給餌することで大腸内酪酸濃度を高めたマウスでは,大腸の制御性T細胞(regulatory T cell:Treg)の割合が増加する5).Treg細胞は抗炎症性サイトカインIL-10などを産生し,過剰な免疫応答を抑制する役割を担うCD4陽性T細胞サブセットである.また,自己免疫疾患や炎症性腸疾患,アレルギーなどの疾病抑制・緩和に寄与している.実際,酪酸化デンプンを与えることで大腸内酪酸濃度を高めたマウスに大腸炎を発症誘導した場合,腸管上皮細胞の障害や好中球の浸潤などの炎症反応は抑制される5).酪酸によるTreg分化誘導には,HDAC阻害によるエピゲノム制御が一部寄与していると考えられる.酪酸はTregのマスター転写因子であるFoxp3のプロモーターおよびconserved noncoding sequence 1(CNS1)エンハンサー領域におけるアセチル化を亢進させ,Treg細胞の分化を促進する5, 6)(図1).一方,無菌マウスに酪酸化デンプンを投与してもTreg細胞の増加は認められない.また,マウス大腸TregはClostridiales speciesなどの酪酸産生菌に反応するT細胞受容体を持つ.以上のように,腸管のTreg細胞誘導には,酪酸とともに細菌由来抗原の提示も必要である可能性が考えられる.短鎖脂肪酸をマウスに飲水投与した研究では,酢酸やプロピオン酸投与で大腸Tregの増加が認められている.これはTreg細胞が発現するGPR43依存的なHDAC阻害を介している.しかし,酪酸とは異なり,プロピオン酸はナイーブT細胞からTregへの分化を誘導するのではなく,TregにおけるFoxp3などの遺伝子発現増加や細胞増殖を促すことで,Treg細胞の恒常性維持に寄与していると考えられる(図1).以上のように,短鎖脂肪酸はTreg細胞の誘導・維持を介して炎症反応の抑制に寄与している.
2)IgA産生細胞への作用
形質細胞などから産生されたIgA抗体は二量体として腸管管腔に分泌され,病原菌やその毒素の排除・中和だけでなく,腸内細菌にも結合することで菌と宿主の共生環境構築に寄与している.無菌マウスにおいては腸管IgA産生細胞がほとんど存在せず,腸内細菌の定着によって誘導される.また,IgAを欠損したactivation-induced cytidine deaminase(AID)欠損マウスでは,セグメント細菌をはじめとする腸内細菌が過剰に増殖する.菌体成分がToll様受容体を介してIgAを誘導することが広く知られているが,短鎖脂肪酸も腸管におけるIgA産生やその特異性に影響する.
マウスに高食物繊維餌を与えた際,短鎖脂肪酸の増加に伴い便中IgA濃度が増加する7, 8).ヒトにおいても,便中短鎖脂肪酸濃度とIgA濃度は正の相関を示す9).個々の短鎖脂肪酸をマウスに飲水投与した場合,プロピオン酸投与で腸間膜リンパ節のIgA産生細胞が増加し,腸管管腔内IgA濃度やIgAに結合した腸内細菌の割合が高まる7).また,in vitroの試験においては,酢酸,プロピオン酸,および酪酸のいずれの刺激下でもB細胞のIgA産生が誘導される7).短鎖脂肪酸はB細胞のHDACを阻害し,クラススイッチ組換えに関わるAID遺伝子(Aicda)制御領域のヒストンアセチル化を促進する(図1).また,短鎖脂肪酸は脂肪酸代謝や解糖活性といったB細胞の代謝に影響を与える.このように,短鎖脂肪酸はB細胞に直接作用し,遺伝子発現や代謝を制御することでIgA産生細胞への分化を促進することが示唆されている7).また,B細胞はGPR41やGPR43を発現しておらず,短鎖脂肪酸のB細胞への直接的作用はこれらの受容体非依存的だと考えられる.一方,GPCR依存的なIgA産生誘導も報告されている.GPR43欠損マウスでは腸管IgA産生が減少し,IgAに結合した腸内細菌の割合も低下する10).筆者らは飲水投与した酢酸がGPR43依存的に腸管IgAを増加させることを確認しているが,この効果はT細胞欠損マウスでも再現できる.B細胞はT細胞依存的または非依存的にIgA産生細胞へのクラススイッチ組換えが誘導されるが,この結果は酢酸がT細胞非依存的にIgA産生を増加させることを示している.実際,酢酸は樹状細胞からのレチノイン酸産生を増加させることでB細胞のIgAクラススイッチ組換えを促進することが示されている10).酪酸化デンプンを投与したマウスにおいても大腸でのIgA濃度増加が確認されており,これにも酪酸による樹状細胞のレチノイン酸産生増加が寄与していることが示唆されている8).また,酪酸の樹状細胞への作用にはHDAC阻害とGPR41/109aシグナル活性化の両方が寄与している8)(図1).
一方,我々のグループは以前,短鎖脂肪酸がT細胞依存的なIgAクラススイッチ組換えに影響することを報告した9).酢酸セルロースを投与することで大腸酢酸濃度を高めた場合,大腸IgA産生細胞の増加とともにIgAの特異性も変化する9).具体的には,酢酸により病原性片利共生細菌である大腸菌に対するIgA産生が促進される.この場合,酢酸はGPCR非依存的にCD4 T細胞に作用し,大腸菌リポ多糖(LPS)への応答性を高める.その結果,T細胞依存的に大腸菌結合性のIgA産生が促進されると考えられる(図1).
以上のように,IgA産生に寄与する短鎖脂肪酸の種類,またはその作用機序についてはさまざまな経路が報告されているが,これは短鎖脂肪酸の投与方法(飲水投与では小腸で吸収されるため大腸の短鎖脂肪酸濃度を高めることができない)や腸内細菌叢の違いなどが影響しているのかもしれない.
3)自然リンパ球への影響
T細胞やB細胞といった獲得免疫系に加え,自然リンパ球(innate lymphoid cells:ILCs)も腸内細菌と宿主との相互作用において重要な役割を担っている.ILCはマスター転写因子や産生サイトカインによってGroup 1(ナチュラルキラー細胞とILC1),Group 2(ILC2),およびGroup 3(ILC3)に大分される.腸管にはILC2やILC3が多く存在し,特にILC3はIL-22を産生することで抗菌ペプチドの産生を誘導するなど,腸管バリア機能の恒常性維持に寄与している.腸内細菌が産生する芳香族炭化水素受容体(aryl hydrocarbon receptor:AhR)リガンド(後述)がILCsの機能を制御することが広く知られているが,近年の研究から短鎖脂肪酸もILCsに作用することが明らかになってきた.
高食物繊維餌を与えたマウスでは腸管でILC3が増加することから,やはり短鎖脂肪酸がILC3の機能や増殖に影響していると考えられる11).実際,ILC3はGPR41やGPR43を発現しており11, 12),GPR43アゴニストによる刺激は腸管バリア機能強化に寄与するサイトカインIL-22の産生を誘導する12).ILCを短鎖脂肪酸で刺激した場合,酢酸,プロピオン酸,および酪酸のいずれもIL-22産生を誘導するが,特に酪酸がIL-22産生を強く誘導する13)(図1).酪酸はHDAC阻害とGPR41シグナルを介してAhRとhypoxia-inducible factor 1α(HIF1α)の発現を高める.さらに,酪酸はヒストン修飾を介してHIF1αのIl22遺伝子プロモーター領域への結合を促進する13).酪酸は同様の機序でCD4 T細胞からのIL-22産生も誘導する13).以上のように,短鎖脂肪酸によるILC3やCD4 T細胞の活性化は腸管バリア機能の恒常性維持だけでなく,感染防御にも貢献していると考えられる.実際,酪酸を飲水投与したマウスでは腸管のIL-22陽性細胞が増加し,Citrobacter rodentiumといった粘膜感染菌の排除が促進される13).
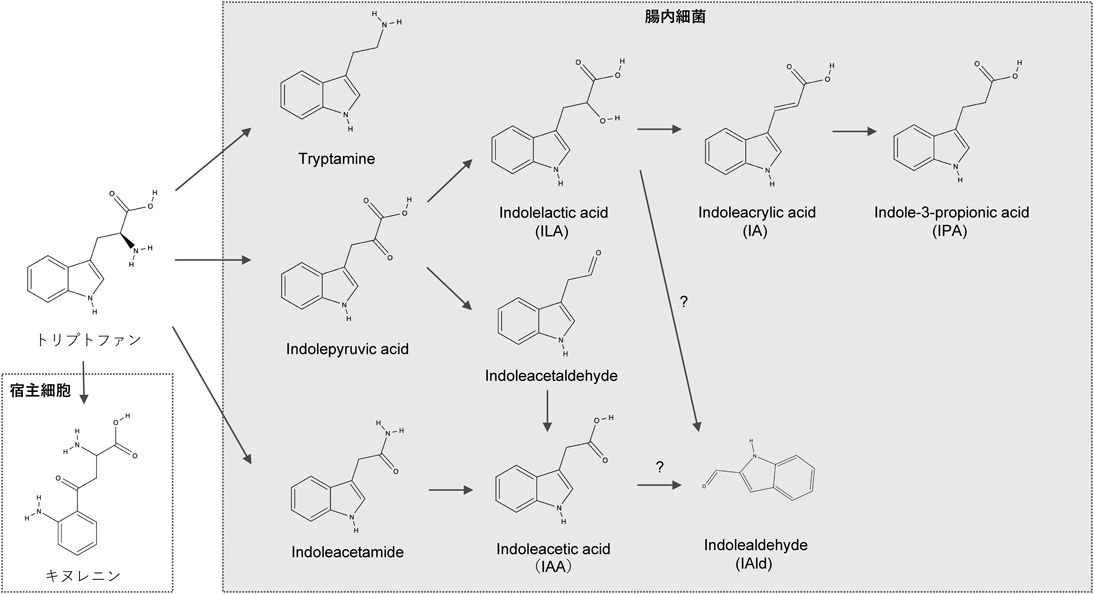
ヒト必須アミノ酸の一つであるトリプトファンは,食事として摂取された場合その大部分は小腸より吸収される.トリプトファンは樹状細胞などが発現するindoleamine 2,3-dioxygenase 1(IDO1)によりキヌレニンに代謝され,エフェクターT細胞の抑制やTregの誘導といった免疫系の制御に寄与する.また,トリプトファンの一部は腸内細菌によって代謝される.腸内細菌によるトリプトファン代謝に関する研究の歴史は古く,100年以上前に大腸菌がトリプトファンをインドールに代謝変換することが報告されている.その後,腸内細菌は種を超えてトリプトファン代謝能を有し,さまざまなインドール類を産生することが明らかにされてきた14)(図2).しかし,腸内細菌によるインドール類産生に関する研究のほとんどはin vitroで行われたものであり,実際にヒト腸管内でどのような腸内細菌が主要なインドール類産生菌なのかについては今後の検討が求められる.
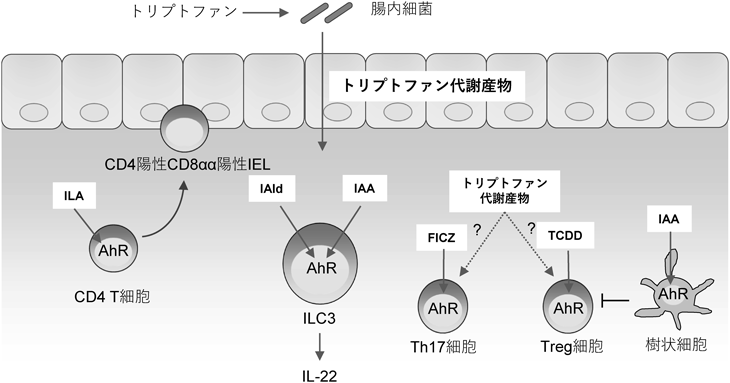
腸内細菌が産生するインドール類のうち,tryptamine, indoleacetic acid(IAA),indoleacrylic acid(IA),indolealdehyde(IAld),indolelactic acid(ILA),5-hydroxy indoleacetic acid(5-HIAA)およびindole-3-propionic acid(IPA)などはAhRリガンドとして機能する.AhRは免疫細胞を含め全身の細胞に広範に発現するリガンド活性化型転写因子であり,インドール類の他にダイオキシンやフラボノイドなどの多様な化合物により活性化される.T細胞においてはサブセットによりAhR発現量が異なり,特にTregやTh17細胞がAhRを高発現している.また,AhRシグナルにより誘導される免疫応答はリガンドにより異なる.たとえば,ダイオキシンとして知られる2,3,7,8-tetrachlorodibenzo-p-dioxin(TCDD)はTregを誘導するが,他のAhRリガンドの6-formylindolo[3,2-b]carbazole(FICZ)はTreg分化を阻害しTh17細胞への分化を促進する.AhRは他の転写因子とともに機能するが,リガンドによってペアとなる転写因子が異なる.TCDDは転写因子c-Mafととともに機能し,IL-27誘導性のIL-10陽性T細胞を誘導する15).一方,FICZはSTAT3とともにTh17細胞への分化を促進する16)(図3).以上のように,インドール類を介したAhRシグナルの活性化は,腸内細菌と免疫系の相互作用において重要な役割を果たしており,各腸内細菌が産生するAhRリガンドにより異なる免疫応答が誘導されると考えられる.
LactobacillusはAhRを介して免疫系を修飾する代表的な菌として研究が進められてきた.Lactobacillusが産生するIAIdはAhR依存的にILC3からのIL-22産生を誘導し,Candida albicans感染に対する抵抗性を高める17).また,炎症性腸疾患感受性遺伝子であるCARD9を欠損したマウスではLactobacillusが減少し,腸内細菌によるトリプトファン代謝活性が低下する18).CARD9欠損マウスではT細胞やILCからのIL-22産生が低下し,実験的大腸炎からの回復が遅く組織修復が不安定だが,これにはLactobacillusが産生するIAAなどのトリプトファン代謝物質の減少が寄与している.実際,CARD9欠損マウスの便中IAA濃度は野生型マウスに比べ低く,便のAhR活性化能も低い.このように,Lactobacillusが産生するIAAなどは,IL-22を誘導することで腸管の恒常性維持に寄与していると考えられる(図3).さらに最新の研究では,Lactobacillusが産生するIAAは腸管のTreg細胞にも影響することも示されている19).
Lactobacillusが産生するILAなどのトリプトファン代謝物質は上皮間リンパ球の制御にも関与する.CD4陽性CD8αα陽性上皮間リンパ球(double-positive intraepithelial lymphocytes:DP IELs)は粘膜固有層のCD4 T細胞に由来し,小腸における炎症抑制の役割を担っている20).無菌マウスではDP IELsが存在しないのだが,L. reuteriが産生するトリプトファン代謝物質はAhRを介してDP IELsを誘導することができる21)(図3).興味深いことに,L. johnsoniiやL. munirisはAhRリガンドとなるトリプトファン代謝物質を産生することができず,AhRを介した免疫制御能は菌種レベルで異なることが示唆されている21).炎症性腸疾患患者や大腸炎モデルマウスにおいてもIAAやIPAといったトリプトファン代謝物質が減少していることから,腸内細菌叢の乱れによるトリプトファン代謝物質の変動が炎症に大きく影響している可能性が考えられる18).
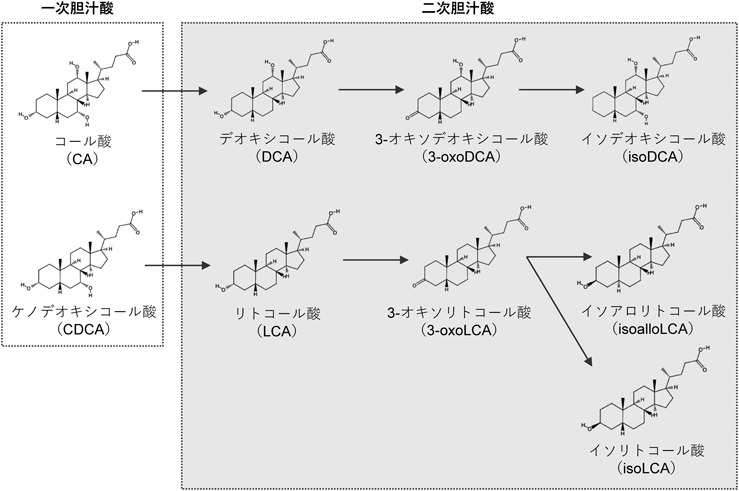
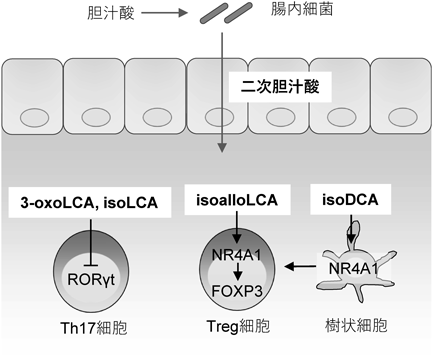
胆汁酸は肝臓でコレステロールから合成される化合物で,そのほとんどはタウリンやグリシンの抱合を受けた形で十二指腸内に分泌される.これを一次胆汁酸と呼び,食事由来脂質の消化吸収を助ける.ヒトではコール酸(cholic acid:CA)とケノデオキシコール酸(chenodeoxycholic acid:CDCA)が主要な一次胆汁酸である.分泌された一次胆汁酸のほとんどは回腸末端部から再吸収され,肝臓で再利用される.しかし,一部の一次胆汁酸は腸内細菌により脱抱合反応,脱水酸化反応,脱水素反応,および水酸化反応といった変換を受け,二次胆汁酸と呼ばれる新たな化合物が生成される.二次胆汁酸の機能や役割については十分に解明されていないが,大腸や肝臓の発がん促進や肥満や糖尿病などの発症や進行に関与することが示されてきた.さらにここ数年,二次胆汁酸のT細胞分化への関与が立て続けに報告されている.先述の短鎖脂肪酸やトリプトファン代謝物質に加え,二次胆汁酸も腸管T細胞の恒常性維持において重要な役割を果たしている可能性がみえてきた.
一次胆汁酸はいくつかのステップを踏んで腸内細菌に代謝される.まず,腸内細菌が発現するbile salt hydrolase(BSH)により脱抱合される.BSHはBacteroidota門,Bacillota門,Actinomycetota門といった主要な腸内細菌に広く保存されている.次に,一部のClostridium属などが発現する7α-ヒドロキシステロイド脱水素酵素(7α-hydroxysteroid dehydrogenase:7α-HSDH)により7α-脱水酸化を受け,CAはデオキシコール酸(deoxycholic acid:DCA)に,CDCAはリトコール酸(lithocholic acid:LCA)にそれぞれ変換される.実際,BSHと7α-HSDHを欠損させたBacteroidesを無菌マウスに定着させた場合,野生型Bacteroidesを定着させた無菌マウスに比べ腸管内の二次胆汁酸濃度は低下する22).さらに腸内細菌は胆汁酸の酸化および還元反応を含む異性化反応にも寄与しており,結果として多様な二次胆汁酸が生成される(図4).
約30種類の一次・二次胆汁酸のT細胞への影響をスクリーニングした研究で,3-oxoLCAが強いTh17細胞分化阻害活性を持つことが示された23).同研究グループはその後,isoLCAもTh17細胞の分化阻害を示すことを報告している24).これらの胆汁酸はTh17細胞のマスター転写因子であるRORγtに直接結合し,その転写活性を阻害する(図5).Eggerthella lentaやGordonibacter pamelaeaeなどが発現する3α-ヒドロキシステロイド脱水素酵素(3α-hydroxysteroid dehydrogenase:3α-HSDH)はLCAから3-oxoLCA,さらにLactobacillus rogosaeやLachnospira pectinoschizaなどが発現する3β-ヒドロキシステロイド脱水素酵素(3β-hydroxysteroid dehydrogenase:3β-HSDH)は3-oxoLCAからisoLCAへの変換に関与している24).興味深いことに,炎症性疾患腸管患者の腸内細菌叢ではE. lentaやRuminococcus gnavusの3α-HSDHホモログがほとんど検出されず,3-oxoLCAやisoLCA濃度も減少している24).また,マウスに3-oxoLCAやisoLCAを投与することで腸管Th17細胞が減少することから23, 24),疾患における腸内細菌叢の変動は胆汁酸代謝物質プロファイルの変化につながり,結果として免疫系の異常な活性化が誘導されることが示唆される.
Th17細胞の分化抑制に加え,二次胆汁酸はTreg細胞の分化促進にも寄与する.IsoaLCAのアイソマーであるisoalloLCAは核内受容体NR4A1のFoxp3遺伝子座への結合を促進し,Foxp3遺伝子の転写を促進する23, 25)(図5).in vivoにおいても,マウスに3-oxoLCAとともにisoalloLCAを投与することで腸管のTreg細胞が増加する23).isoalloLCAは無菌マウスの腸内では検出されないことから,ある種の腸内細菌がisoalloLCAの産生に関与していると考えられる23).実際,isoalloLCA産生能を持つ腸内細菌をスクリーニングした結果,Parabacteroides merdae, Bacteroides dorei, Bacteroides vulgatus, Odoribacter laneusなどのBacteroidota門に属する菌が3-oxoLCAからisoalloLCAに変換できることが明らかになっている25, 26).前述のようにLCAから3-oxoLCAへの変換には他の菌が関与しており,機能の異なる腸内細菌が協調して多様な二次胆汁酸を生成していると考えられる.また,炎症性腸疾患患者の便ではisoalloLCA濃度が減少している一方,百寿者ではisoalloLCAが増加しており,ヒトにおいてもisoalloLCAが重要な役割を果たしていることが示唆されている25, 26).ヒトの腸管内で検出される二次胆汁酸isoDCAもTreg細胞誘導能が認められているが,isoDCAはT細胞に直接作用するのではなく,樹状細胞を介してTreg細胞を誘導する.isoDCAはNR1H4を介して樹状細胞に作用し,抗原提示に関する遺伝子や炎症誘導に関わる遺伝子群の発現を減少させる27).
短鎖脂肪酸やトリプトファン代謝物質と同様に,胆汁酸プロファイルも食事内容によって変化する.最低限の栄養素を含む餌(minimal diet)から栄養素豊富な餌(nutrient-rich diet)に切り替えることで,腸管内の脱抱合型一胆汁酸と二次胆汁酸が増加する22).これは,nutrient-rich dietが抱合型一胆汁酸の分泌を誘導し,腸内細菌による脱抱合と二次胆汁酸への変換が促進されるためと考えられる.また,minimal dietを与えたマウスに種々の一次胆汁酸や二次胆汁酸を単独投与しても腸管のTreg細胞は増加せず,いくつかの胆汁酸を組み合わせて投与することでTreg細胞を誘導できることが示されている22).この場合,胆汁酸のmixtureはビタミンD受容体(vitamin D receptor:VDR)やNR4A1を介してTreg細胞を誘導する.また,ビタミンDでVDRを刺激してもTreg細胞を誘導できず,VDRを介したTreg細胞誘導は胆汁酸特異的である.
本稿では主に腸管T細胞やB細胞,およびILCに対する腸内細菌代謝物質の作用を紹介した.しかし,代謝物質は腸管上皮細胞やマクロファージなどの自然免疫系,さらには肝臓や神経系などの多臓器にも影響する28).また,腸内細菌が産生する分岐鎖アミノ酸や種々の脂質代謝物質も宿主に影響する29, 30).このように,これまでの腸内細菌叢の解析に加え腸内代謝物質プロファイルを明らかにすることは,腸内細菌叢–宿主間相互作用を理解する上で必須であるといえる.
炎症性腸疾患のような腸管免疫系の異常を起因とする疾患に加え,多発性硬化症などの腸管外の炎症疾患においても,短鎖脂肪酸などの代謝産物が重要な役割を果たしていることが明らかになってきた31).これら腸管外炎症疾患におけるトリプトファン代謝産物や二次胆汁酸の影響についても報告が相次いでおり,今後さらなる研究が期待される32, 33).
以上のように,腸内代謝物質による免疫系への影響が明らかになりつつある.さらに,ヒトにおける食事成分–腸内細菌間相互作用による代謝物質プロファイルの変化の理解を進めることで,疾患予防や治療につながる理想的な腸内環境のデザインが可能になるかもしれない.