腸内細菌研究が進む中で,腸内細菌叢の乱れ(dysbiosis)が炎症性腸疾患(inflammatory bowel disease:IBD)や過敏性腸症候群といった消化器疾患だけでなく,肥満や糖尿病などの代謝性疾患,関節リウマチや多発性硬化症などの自己免疫疾患,自閉症やうつなどの精神疾患といったさまざまな疾患に関与していることが明らかになってきており1),dysbiosisの改善を目的とした腸内細菌叢移植療法[便微生物叢移植(fecal microbiota transplantation:FMT)とも呼ぶ]が新規治療として注目が集まっている.抗菌剤を長期服用することに起因するClostridioides difficile感染症(Clostridioides difficile infection:CDI)(2016年にClostridium difficileより変更)に対してFMTが非常に高い奏功率を示したことが2013年に報告され1),IBDだけでなく,糖尿病やメタボリックシンドロームなど代謝疾患に関しても実用化に向けて幅広く臨床研究が行われている2).本邦においても,近年急増する潰瘍性大腸炎(ulcerative colitis:UC)患者への新しい治療選択肢として期待が高まっている状況であり,2023年1月から先進医療Bとして開始となった.本稿では,最近のFMTの研究報告と当施設で進行中の臨床研究である「抗菌剤併用FMT」の研究結果も含めて,FMTの現状と今後の展望について概説する.
主に抗菌剤の長期投与が原因で生じるCDIは典型的なdysbiosisが原因の疾患といえる.本邦においては主にバンコマイシンやメトロニダゾールが治療として使用されるが,臨床上では治療抵抗性の症例を多く経験する.特に抗菌薬の長期投与,長期入院,65歳以上の高齢者や他疾患を併発している患者では再発しやすく難治性CDIとなりやすい.難治性CDIへのFMT治療に関して論文での報告をたどると,1958年にEisemanらが4例の再発性の偽膜性腸炎の症例に対して1~3回注腸でFMTを行うことにより副作用なく全例で症状改善を認めたという報告3)があるが,その後,いくつかの数例の症例報告はあったもののまとまった研究報告はされていなかった.2013年にvan NoodらによりCDIの標準治療であるバンコマイシン投与とFMTのランダム化比較試験(randomized controlled trial:RCT)の結果が報告された4).FMT群(バンコマイシン2000 mgを4日間投与後,十二指腸チューブを用いてドナー便投与),バンコマイシン単独投与群(2000 mgを14日間投与),またバンコマイシンおよび腸洗浄群と比較し,FMT群では1回のFMTで81%(16人中13人)が治癒し,不応例も別のドナー便を投与することにより67%(3人中2人)が治癒し,合計で94%という驚異的な治癒率を報告したものである.また,CDI症例に対するFMT前後の腸内細菌叢の解析では,FMT後には腸内細菌叢の多様性(diversity)が回復し,さらには健常ドナーと近似してくるという興味深い結果であった.この報告を踏まえて,アメリカやオランダでのCDIの2014年治療ガイドラインでは,バンコマイシン不能性の再発性CDIの補助療法としてFMTが推奨されており,臨床的にFMTが応用できている代表例といえる.その後,投与経路や回数に関係なく高率にCDIが治癒していることが報告されている5).欧米では,抗菌剤耐性のC. difficile NAP1(North American Pulsed-field gel electrophoresis type 1)株の院内感染が問題になっており,NAP1株が院内感染の30%に認められたとの報告がある.このような薬剤耐性のある難治性CDIの増加と重症化に連れて,薬剤に頼らない腸内細菌療法としてFMTの必要性がますます高まっていくといえる.本邦においては2020年4月から滋賀医科大学,藤田医科大学,金沢大学,順天堂大学において先進医療B(jRCTs051190048)として開始となり,CDIに対するFMT治療の幕開けとなった.まだ,CDI院内感染は深刻化していないが,国際化が進む中で,FMTが施行できる体制をさらに整えていくべきと考える.
本邦において難病指定疾患である潰瘍性大腸炎(UC)の患者数は毎年約1万人の増加を認め,2019年度には20万人を超える状況となっている.UCは「増悪,寛解を繰り返し,治癒不能な疾患」であり,生物製剤や免疫抑制剤の登場により寛解導入率は向上したものの,中止基準がなく長期使用を余儀なくされるため,免疫寛容の問題から小児や高齢発症患者には使用しづらく,副作用のリスクも大きい.副作用の少ない根本的治療が待たれており,dysbiosisが関連する代表疾患であるUCがFMTのターゲットになるのは自然であったといえる.
UCに対してのFMTは1989年にBennetらが1例報告したのが最初で,抗菌薬投与後,注腸による1回のFMTで寛解に至ったことが報告された6).その後もFMTの有効例の報告はあるが,症例報告がほとんどであり,その治療効果について議論の余地が残るものであった.UCに対するFMTのランダム化比較試験(RCT)は五つ(一つは凍結乾燥カプセル化)報告されている(表1).2015年アメリカ学術誌Gastroenterologyに時を同じくしてUCに対するFMTのRCT論文が二つ同時に掲載された7, 8).一つはカナダのMoayyediらの報告で,UC患者のFMT群に1回50 mLの健常ドナー便を週1回,注腸で6週間連続投与,それに対してプラセボ群には生理食塩水を投与するというものだった.FMT群は38人中9人(24%)が,プラセボ群は37人中2人(5%)が寛解導入され,FMT群の方で有意に寛解率が高いという結果であった.もう一方はオランダのRossenらの報告で,48人のUC患者を2群に分け,FMT群は経鼻十二指腸チューブからドナー便,コントロール群には自家便移植を0週と3週目に投与した.治療を完遂した症例での寛解率は,FMT群は41.2%,コントロール群ではそれぞれ25.0%であり,FMTのUC寛解に対する有効性は認められないというものであった.UCに対するFMTの初めてのRCTであったが,相反する結果となったことは非常に興味深い.その要因として,FMTの投与経路や回数などの方法が大きく異なっていることが考えられる.CDIでは投与方法などにかかわらず高い奏功率が示されているが,UCに対するFMTのプロトコールの作成が必要であることを示す結果にもなったといえる.いずれにせよ,これらの論文からはFMT単独ではUCに対する治療効果は不透明であり,かつ既存の薬剤治療と比較しても優位性がないことも明らかとなった.腸内細菌の解析では,主に多様性の回復やドナーとレシピエントの類似性が言及されている.特にRossenらの論文での寛解例では酪酸産生菌であるClostridium clusters IVやXIVaとの関与が示唆されているが,同様の腸内細菌の変化がプラセボ群の効果があった症例でも生じており,改善した結果の腸内細菌叢の変化と考えられる所見であり,治療効果メカニズムの十分な解明には至らなかったと考えられる.
表1 潰瘍性大腸炎に対するFMTのRCT著者,出版年,
国 | Rossen, 2015,
オランダ | Moayyedi, 2015,
カナダ | Paramsothy, 2017,
オーストラリア | Costello, 2019,
オーストラリア | Haifer, 2021,
オーストラリア |
|---|
| 患者数 | 48
(FMT 23, プラセボ25) | 75
(FMT 38, プラセボ37) | 81
(FMT 41, プラセボ40) | 73
(FMT 38, プラセボ35) | 35
(FMT 15, プラセボ20) |
| 対象 | 軽症,中等症 | 軽症,中等症,重症 | 軽症,中等症 | 軽症,中等症 | 軽症,中等症 |
| 前処置 | 腸管洗浄 | — | 腸管洗浄 | 腸管洗浄 | 抗菌薬3剤併用 |
| ステロイド | 併用可(<10 mg) | 併用可 | 漸減2.5 mg/w to free | 漸減5 mg/w to free | 漸減2.5 mg/w to free |
| FMT回数 | 2回 | 6回 | 41回 | 3回 | 49回 |
| 投与量・経路 | 500 mL十二指腸注入 | 50 mLエネマ | 150 mL内視鏡
150 mLエネマ | 200 mL内視鏡
100 mLエネマ | 凍結乾燥カプセル六つ
(便2.1 gを含む) |
| ドナー | 単独 | 単独 | 複数(3~7人) | 複数(3~4人) | 単独 |
| 便状態 | 生便 | 生便,凍結 | 凍結−80°C | 凍結−80°C | 冷蔵4°C |
主要評価項目
(FMT対プラセボ) | 寛解導入@12週
30% vs. 20%,p=0.51 | 寛解導入@7週
24% vs. 5%,p=0.03 | 寛解導入@8週
27% vs. 8%,p=0.02 | 寛解導入@8週
32% vs. 9%,p=0.03 | 寛解導入@8週
53% vs. 15%,p=0.027 |
UCに対するFMTの治療効果に関して定まった見解がない状況のなか,2017年2月に3番目のRCTがオーストラリアのParamsothyらにより報告された9).この論文は3人から7人のドナー便を混ぜ合わせることにより,ドナー便の腸内細菌の多様性を高め,週に5回自己浣腸を計8週間行い,合計41回FMTを施行するというプロトコールであった.効果判定の設定は臨床的寛解かつ内視鏡的寛解もしくは奏効とし,かつステロイド(プレドニゾロン)を減量していきながら行うといった厳しい判定基準ながらFMT群では27%の達成率が示され,FMTの治療効果が証明されたが,凍結ドナー便を40回自己浣腸する方法であり,治療方法の煩雑さを考慮すると現実的な治療になりうるかは議論を要する結果であった.2019年のRCTでは,Costelloらが嫌気性下でFMT溶液を作製し,3回投与のみで寛解導入を達成したことを報告した10).最新の2021年のRCTでは,凍結乾燥化させたドナー便をカプセルに入れて内服する方式を採用しており,2週間3種類の抗菌剤を内服した後に8週間カプセルを内服継続するデザインであり,介入後の評価では73%と非常に高い臨床的寛解導入を達成した11).また,現在重症,難治性UCの治療に用いられている生物学的製剤5種類(インフリキシマブ,アダリムマブ,トファシチニブ,ゴリムマブ,ベドリズマブ)とFMTの寛解導入率,症状改善室についてのネットワークメタ解析が報告され12),寛解導入率,症状改善率ともに標準療法である生物学的製剤と比べて遜色ない治療効果であることが示された.
4. 最適なFMTの確立を目指して(当施設での成果)
1)当施設のプロトコール
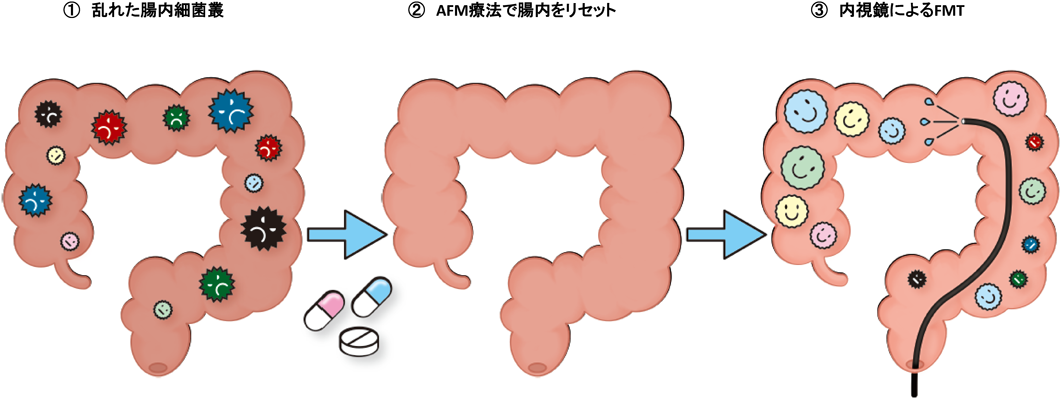
ヒトの腸内細菌叢は40兆個ともいわれる数多くの腸内細菌からなっており,単純にFMTを行うだけでは,効率的な定着は望めず,dysbiosisの改善はみられないと考え,我々は抗菌剤をFMT前に投与し(下記3剤の頭文字よりAFM療法と呼ぶ),レシピエントの腸内細菌叢を減らしてFMTを施行する併用療法を考案し,実施している.AFM療法はアモキシシリン,ホスホマイシン,メトロニダゾールを2週間内服するものであり,乱れた腸内細菌叢の環境をFMT前にリセットすることで移植する腸内細菌の効率的な定着を狙ったものであった.我々はこの併用療法をAntibiotics-FMTの意味と,AFM+FMTの重なるアルファベット(FM)を短縮し,A-FMTと提唱した(図1).FMTに先行してAFM療法を施行し,2週間内服後40時間あけてFMTを施行するプロトコールである.
2)腸内細菌叢の変化と治療効果の関連
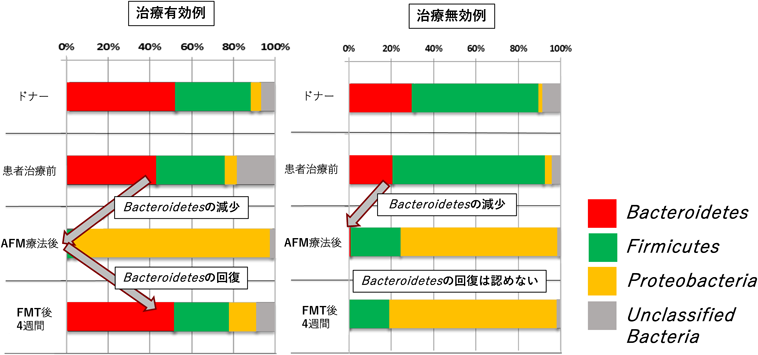
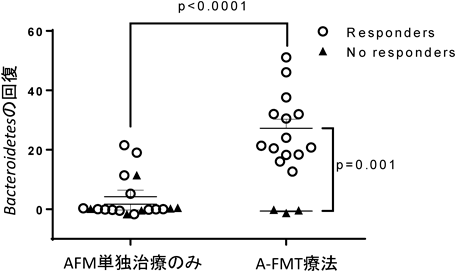
この手法は以前より報告があり,Borodyらはバンコマイシン,リファンピシリン,メトロニダゾールを前投与し5回のFMTで高い治療効果を報告した13).一方Angeelbergerらは,メトロニダゾールの前投与をFMTと組み合わせたが十分な治療効果が得られなかったことを報告している14).我々はより効率的なUCに対する新規FMTプロトコールの確立を目指して,UCへの有効性が報告されている抗菌剤療法(アモキシシリン,テトラサイクリン,メトロニダゾール:ATM)のテトラサイクリンをホスホマイシンに変更したAFM療法をFMTの前治療として2週間投与するFMT併用療法(A-FMT)を提唱した(概念図,図1).そして,2014年6月に学内倫理委員会の承認を得て,同年7月に臨床研究「UCに対する抗菌薬療法併用FMTの有効性の検討」(UMIN ID000014152)を開始した.2014年7月から2016年3月にかけて41例のUC患者を対象にそれぞれA-FMT(21例),AFM単独(20例)の治療を実施し,治療経過中の腸内細菌叢の変化について次世代シーケンサーを用いて解析し,その臨床データとの関連について報告した15).AFM療法後にはBacteroidetes門の割合が著明に減少したが,FMT後4週間に治療有効例ではBacteroidetes門が有意に回復し,無効例では回復を示さなかった(図2).一方,抗菌剤療法(AFM単独)群では,治療後4週間経過してもBacteroidetesは十分に回復せず,治療効果と関連性も認めなかった(図3).以上からBacteroidetesの変化がA-FMTの治療効果に強く関与していることが示された.そこでBacteroidetesの種レベルの網羅的解析を行ったところ,治療効果のあった症例では種レベルでの多様性がA-FMT後に改善し,ドナーの腸内細菌組成に近似していることを報告した16).これはAFM療法による抗菌剤前処置治療が,ドナーの腸内細菌の効率的な移植に関与し,有効例では実際に移植されていることを初めて証明したものであった.
3)ドナーマッチングと長期治療効果
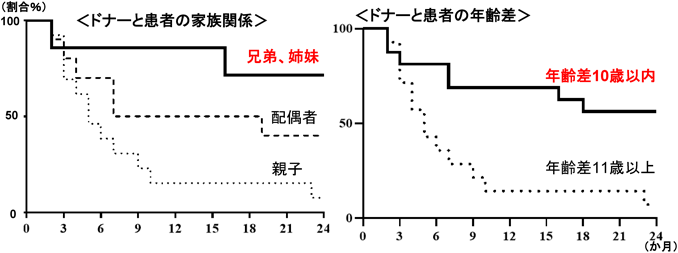
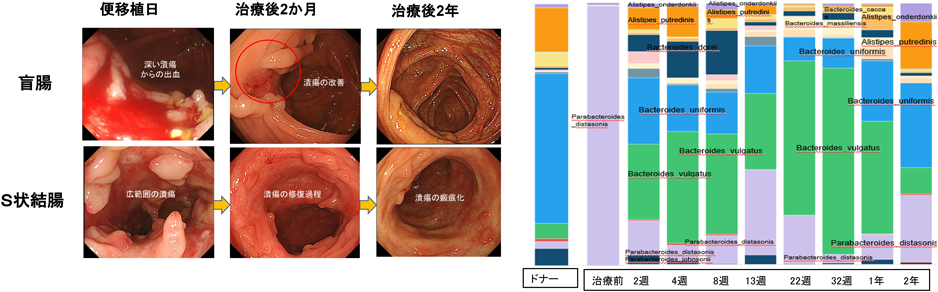
UC患者92例(A-FMT療法55例,AFM単独37例)の治療1か月後の短期治療効果の評価では,治療効果率65.9%および寛解導入率40.4%と従来のFMTの報告と比べてきわめて高い治療効果が認められ,長期治療効果もAFM単独群より優位に高いことを報告した17).短期治療効果とドナーと患者の関係との関連は認めなかったが,治療後2年間の長期的寛解に①兄弟間移植であること,②患者とドナーの年齢差が10歳以内であることが関連していることが明らかとなった(図4).そして,弟ドナー便でのA-FMT治療1回のみで2年間寛解維持できた著効例の菌種レベルの腸内細菌叢解析の結果では,ドナーの腸内細菌叢が効率的に移植され,2年間ほぼ変わらず定着,維持できていた(図5).長期間にわたってドナーの腸内細菌叢が安定化(特にBacteroidetes種が定着)することが明らかになった.以上の結果より,兄弟の腸内細菌叢は患者の疾患発症前の健康な状態に近いと考えられ,患者にとって理想的な腸内細菌叢である可能性がある.また,年齢層により安定する腸内細菌の種類が異なっているため,年齢差が大きな場合に腸内細菌の長期の定着がうまくいかないことが考察された.ドナー・患者マッチングがA-FMTの治療効果にとって非常に重要であることが明らかとなり,層別化FMT,マイクロバイオーム創薬の展開にもつながっていくと思われる.
FMTについては再発性CDIやUC治療にとどまらず,適応疾患の拡大が進んでおり,FMT用便溶液を加工することでマイクロバイオーム医薬品(便由来製剤)の開発という新たなイノベーションにもつながっている.
1)FMTと免疫チェックポイント阻害剤(ICI)への応用
以前より腸内環境と免疫チェックポイント阻害剤(immune checkpoint inhibitor:ICI)の治療効果については知られていたが,2020年にScience誌に報告された症例報告ではanti-PD-1抵抗性の転移性メラノーマ患者10名に対してFMTを実施後,再びanti-PD-1治療を施したところ2名で部分奏功,1名で著効が観察された18).さらに,2018年にNature Medicine誌に報告された症例報告ではICIによる難治性腸炎患者2名に対してFMTを実施したところ,両者とも寛解することに成功した19).
ICIは奏効した場合の効果の高さからグローバルで急成長している抗がん剤であるがその奏効率は10~20%との報告があり,一方で副作用として重篤な腸炎が数%から20%あると報告されている.こうしたICIの弱点を補完するアジュバントとしてFMTの有効性が観察されたことは,直近のソリューションとしてのFMTの価値の証明であるとともに,腸内細菌とがん免疫の深い関連を示唆するものであり,次のマイクロバイオーム創薬への発展につながると考える.
2)アレルギー疾患への応用
出生直後の腸内細菌叢の変化がアレルギー発症に関与することが報告され20),アレルギー疾患の予防のためFMTが注目されていたが,経膣分娩によって産まれた児は帝王切開によって産まれた児と比べ,母体の腸内細菌叢が定着され,さらに帝王切開によって産まれた新生児に対し母親の便を薄めた便溶液を使用したFMTを行ったところ,多様性が高まり,経膣分娩によって産まれた児の腸内細菌叢と有意な類似性を示したことが報告された21).つまり,成人患者と違い,乳児においてはシンプルなFMTで十分に大きな腸内環境変化を引き起こせる可能性を示したものであり,FMTが積極的にアレルギー予防策になりうる可能性を示したものである.予防ほど簡単ではないと思われるが,小児期以降のアレルギー疾患患者であれば,dysbiosisを改善すべく,A-FMTのように抗菌剤で腸内細菌叢をリセットし,マッチングのよいドナーを選択することが有用かもしれない.
3)中枢系疾患への応用
自閉症(autism spectrum disorder:ASD)患者の一部は行動症状に加えて便秘などの消化器症状も併発している.こうした患者の腸内細菌叢には特定の菌種が少ないことが明らかになり,FMTで腸内環境を整えたところ,消化器症状と行動症状が同時に改善したことが報告された22).ASDで減少している菌種はオキシトシン合成に関与していると考えられている.
4)マイクロバイオーム創薬の起点
ある意味FMTはすべてのマイクロバイオームを移植して「腸内環境を整えることで臨床効果が出る」という「究極の回答」を先に得る手段として機能しており,マイクロバイオーム創薬の起点となりうる治療そのものでありながら,創薬シーズ探索メソッドともいえる.現在,特に海外において腸内細菌叢中の特定の菌株のみを単離培養し医薬品として用いる生菌製剤の開発が盛んになっている.A-FMTと同等以上の有効性のある生菌製剤ができれば,A-FMTのように医療技術ではなく通常の医薬品として社会に流通させることが可能となり,より多くの患者がより簡便に利用できるようになることが期待される.生菌製剤を研究開発するアプローチとして,FMTを実施して患者に効果のあった菌を発見することを起点とするリバーストランスレーショナルと呼ばれる手法が国内外で実績があり,順天堂大学でも同様のアプローチで有効菌候補を発見してきている.国立研究開発法人日本医療研究開発機構(AMED)が公募した令和3年度「次世代治療・診断実現のための創薬基盤技術開発事業(腸内マイクロバイオーム制御による次世代創薬技術の開発)」の「MB創薬に関わる技術開発および基盤構築事業」として,産業技術総合研究所を代表機関とする「リバーストランスレーショナル創薬に向けた包括的マイクロバイオーム制御基盤技術開発—マイクロバイオーム創薬エコシステム構築に向けて—」が採択された.順天堂大学はその中の課題代表施設として炎症性腸疾患に関するリバーストランスレーショナルによる創薬シーズ創製を担当し,共同研究機関のメタジェンセラピューティクス株式会社は当課題の分担者となっており,産官学あげてわが国における腸内細菌創薬基盤の構築を目指す事業で重要な役割を担っている.A-FMTでUC患者を治療することで得られるデータは,AMED事業とも連携することで創薬研究開発にも直結する.一日も早くA-FMTの社会基盤を作ることが,10年以上かかると予想される腸内細菌創薬の実現を早め,多くのUC患者を救うことにつながると考える.
1)海外でのFMT実装化
前述のようにFMT研究は積極的に行われているが,米国ではすでに実装化の段階に進んでいる.腸内細菌叢移植(FMT)を取り巻く世界の状況として,米国ではFMT基盤を活用した便由来製剤(便に加工を施した医薬品)の治験が進み,2022年11月にCDI向けの腸内細菌叢溶液(浣腸用);ReBYOTA(Ferring Pharmaceuticals社)が薬事承認された.また,オーストラリアにおいてもバイオベンチャーBiomeBank社のCDI向けFMT溶液が当局に承認された.優れた治療効果が報告されてからの展開が非常に早く,産官学連携での社会実装化がなされているといえる.
2)本邦におけるFMT,先進医療開始
我々の研究グループでは,2022年5月に本邦における有効性・安全性の高いFMT基盤を築くため,「標準化された安全な腸内細菌叢溶液を作成・管理するための細菌叢バンクに関する基礎研究」(UMIN登録番号000049692)を開始した.産学連携の“腸内細菌叢バンク”の構築により,細菌叢溶液調製法を標準化,安定化することを目指し,メタジェンセラピューティクス株式会社との共同研究により,バイオ医薬品向けのシングルユース容器を活用した簡便な腸内細菌叢溶液の製造工程を開発した.また,海外のガイドラインを参考としたドナースクリーニング項目の整理,腸内細菌叢溶液のロット単位での検査などによりFMTの安全性をさらに強化することを可能にした.また,当研究グループでは本成果を活用して,2023年1月より「活動期潰瘍性大腸炎患者を対象とする抗菌薬併用腸内細菌叢移植療法」の先進医療Bの特定臨床研究を開始し,より安全で効果的なFMT治療の実装化を押し進めていく.
FMT先進医療の最も重要な意義は,医療技術を社会実装するための先進医療の枠組みで本研究を実施することにより,実績を積み重ねてきたA-FMT療法の保険収載を目指し,広く患者に届けることである.先行研究と比較して,腸内細菌叢バンクの仕組みの検証や,SOP(standard operating procedures)導入および複数回の検査の実施による安全性の向上,海外先行事例を踏襲したFMT回数の実施による有効性向上などを実現しており,いずれも安全で有効なA-FMT療法を広く普及させるための改良点である.
UCとdysbiosisの関連は多くの研究で明らかになってきており,dysbiosisを強制的に修正できるA-FMT療法は,ステロイド製剤や生物学的製剤とは作用機序がまったく異なる新しい治療オプションである.コロナウイルス流行下でのステロイド使用抑制が要請され,高価で中止基準のない生物学的製剤の医療経済上の問題が注目されるなど,今後もUC治療戦略はさまざまな社会的情勢の影響を受けながら変化することが求められると考えられる.A-FMTという従来の医薬品とは大きく異なる治療オプションを提供することは,多様化するUC治療ニーズに応える観点でもきわめて重要であり,多くの患者にとって有益であると考えられる.
また,A-FMT療法を社会実装する上で腸内細菌叢バンクの構築が不可欠である.A-FMTで使用する腸内細菌叢溶液を安全かつ安定的に供給するためには,多くの便ドナーの参加,管理された溶液調整・特性解析・スクリーニング解析プロセスなど多大な労力が必要となる.A-FMTを実施する医師一人ひとりが腸内細菌叢バンクを構築し,管理運営しつつ医療提供することは現実的ではなく,日本国内でFMTへのアクセスが限定される原因になっている.米国,オーストラリアなどの先行する国では,腸内細菌叢バンクがすでに運用され,多くの患者がアクセスできるようになってきている.わが国における同様の仕組みの構築が,多くの患者と医師の共通の願いとなっている.
我々の施設では約210名の潰瘍性大腸炎患者と,190名のドナーがFMT臨床研究に参加(2023年3月時点)し,その蓄積したデータを多角的に分析することにより治療メカニズムの解明と,より効果の高い手法について検討中である.我々のA-FMTの治療効果やFMTの他疾患への適応拡大については,より高い質の臨床研究を行う必要があるが,それには感染症リスクのない安定したドナー便溶液の供給が必要となる.法整備も含めてFMT自体の治療で多くの患者へ供給できる体制を作り,充実したFMT治療の研究を通して,治療効果に関連する有効な細菌種の同定や,腸内細菌-粘膜免疫応答のメカニズムを解明することは,難治性疾患をはじめとするdysbiosisに関わる疾患の「根本的腸内細菌療法の確立」に大きく寄与できるものと考える.
引用文献References
1) Morgan, X.C., Tickle, T.L., Sokol, H., Gevers, D., Devaney, K.L., Ward, D.V., Reyes, J.A., Shah, S.A., LeLeiko, N., Snapper, S.B., et al. (2012) Dysfunction of the intestinal microbiome in inflammatory bowel disease and treatment. Genome Biol., 13, R79.
2) Nemoto, H., Kataoka, K., Ishikawa, H., Ikata, K., Arimochi, H., Iwasaki, T., Ohnishi, Y., Kuwahara, T., & Yasutomo, K. (2012) Reduced diversity and imbalance of fecal microbiota in patients with ulcerative colitis. Dig. Dis. Sci., 57, 2955–2964.
3) Eiseman, B., Silen, W., Bascom, G.S., & Kauvar, A.J. (1958) Fecal enema as an adjunct in the treatment of pseudomembranous enterocolitis. Surgery, 44, 854–859.
4) van Nood, E., Vrieze, A., Nieuwdorp, M., Fuentes, S., Zoetendal, E.G., de Vos, W.M., Visser, C.E., Kuijper, E.J., Bartelsman, J.F., Tijssen, J.G., et al. (2013) Duodenal infusion of donor feces for recurrent clostridium difficile. N. Engl. J. Med., 368, 407–415.
5) Frank, D.N., Robertson, C.E., Hamm, C.M., Kpadeh, Z., Zhang, T., Chen, H., Zhu, W., Sartor, R.B., Boedeker, E.C., Harpaz, N., et al. (2011) Disease phenotype and genotype are associated with shifts in intestinal-associated microbiota in inflammatory bowel diseases. Inflamm. Bowel Dis., 17, 179–184.
6) Bennet, J.D. & Brinkman, M. (1989) Treatment of ulcerative colitis by implantation of normal colonic flora. Lancet, 1, 164.
7) Rossen, N.G., Fuentes, S., van der Spek, M.J., Tijssen, J.G., Hartman, J.H., Duflou, A., Löwenberg, M., van den Brink, G.R., Mathus-Vliegen, E.M., de Vos, W.M., et al. (2015) Findings from a randomized controlled trial of fecal transplantation for patients with ulcerative colitis. Gastroenterology, 149, 110–118.e4.
8) Moayyedi, P., Surette, M.G., Kim, P.T., Libertucci, J., Wolfe, M., Onischi, C., Armstrong, D., Marshall, J.K., Kassam, Z., Reinisch, W., et al. (2015) Fecal microbiota transplantation induces remission in patients with active ulcerative colitis in a randomized controlled trial. Gastroenterology, 149, 102–109.e6.
9) Paramsothy, S., Kamm, M.A., Kaakoush, N.O., Walsh, A.J., van den Bogaerde, J., Samuel, D., Leong, R.W.L., Connor, S., Ng, W., Paramsothy, R., et al. (2017) Multidonor intensive faecal microbiota transplantation for active ulcerative colitis: a randomised placebo-controlled trial. Lancet, 389, 1218–1228.
10) Costello, S.P., Hughes, P.A., Waters, O., Bryant, R.V., Vincent, A.D., Blatchford, P., Katsikeros, R., Makanyanga, J., Campaniello, M.A., Mavrangelos, C., et al. (2019) Effect of fecal microbiota transplantation on 8-week remission in patients with ulcerative colitis: A randomized clinical trial. JAMA, 321, 156–164.
11) Haifer, C., Paramsothy, S., Kaakoush, N.O., Saikal, A., Ghaly, S., Yang, T., Luu, L.D.W., Borody, T.J., & Leong, R.W. (2022) Lyophilised oral faecal microbiota transplantation for ulcerative colitis (LOTUS): a randomised, double-blind, placebo-controlled trial. Lancet Gastroenterol. Hepatol., 7, 141–151.
12) Zhou, H.Y., Guo, B., Lufumpa, E., Li, X.M., Chen, L.H., Meng, X., & Li, B.Z. (2021) Comparative of the effectiveness and safety of biological agents, tofacitinib, and fecal microbiota transplantation in ulcerative colitis: Systematic review and network meta-analysis. Immunol. Invest., 50, 323–337.
13) Borody, T.J., Warren, E.F., Leis, S., Surace, R., & Ashman, O. (2003) Treatment of ulcerative colitis using fecal bacteriotherapy. J. Clin. Gastroenterol., 37, 42–47.
14) Angelberger, S., Reinisch, W., Makristathis, A., Lichtenberger, C., Dejaco, C., Papay, P., Novacek, G., Trauner, M., Loy, A., & Berry, D. (2013) Temporal bacterial community dynamics vary among ulcerative colitis patients after fecal microbiota transplantation. Am. J. Gastroenterol., 108, 1620–1630.
15) Ishikawa, D., Sasaki, T., Osada, T., Kuwahara-Arai, K., Haga, K., Shibuya, T., Hiramatsu, K., & Watanabe, S. (2017) Changes in intestinal microbiota following combination therapy with fecal microbial transplantation and antibiotics for ulcerative colitis. Inflamm. Bowel Dis., 23, 116–125.
16) Ishikawa, D., Sasaki, T., Takahashi, M., Kuwahara-Arai, K., Haga, K., Ito, S., Okahara, K., Nakajima, A., Shibuya, T., Osada, T., et al. (2018) The microbial composition of bacteroidetes species in ulcerative colitis is effectively improved by combination therapy with fecal microbiota transplantation and antibiotics. Inflamm. Bowel Dis., 24, 2590–2598.
17) Okahara, K., Ishikawa, D., Nomura, K., Ito, S., Haga, K., Takahashi, M., Shibuya, T., Osada, T., & Nagahara, A. (2020) Matching between donors and ulcerative colitis patients is important for long-term maintenance after fecal microbiota transplantation. J. Clin. Med., 9, 1650.
18) Baruch, E.N., Youngster, I., Ben-Betzalel, G., Ortenberg, R., Lahat, A., Katz, L., Adler, K., Dick-Necula, D., Raskin, S., Bloch, N., et al. (2021) Fecal microbiota transplant promotes response in immunotherapy-refractory melanoma patients. Science, 371, 602–609.
19) Wang, Y., Wiesnoski, D.H., Helmink, B.A., Gopalakrishnan, V., Choi, K., DuPont, H.L., Jiang, Z.D., Abu-Sbeih, H., Sanchez, C.A., Chang, C.C., et al. (2018) Fecal microbiota transplantation for refractory immune checkpoint inhibitor-associated colitis. Nat. Med., 24, 1804–1808.
20) Papathoma, E., Triga, M., Fouzas, S., & Dimitriou, G. (2016) Cesarean section delivery and development of food allergy and atopic dermatitis in early childhood. Pediatr. Allergy Immunol., 27, 419–424.
21) Korpela, K., Helve, O., Kolho, K.-L., Saisto, T., Skogberg, K., Dikareva, E., Stefanovic, V., Salonen, A., Andersson, S., & de Vos, W.M. (2020) Maternal fecal microbiota transplantation in cesarean-born infants rapidly restores normal gut microbial development: A proof-of-concept study. Cell, 183, 1–11.
22) Kang, D.W., Adams, J.B., Coleman, D.M., Pollard, E.L., Maldonado, J., McDonough-Means, S., Caporaso, J.G., & Krajmalnik-Brown, R. (2019) Long-term benefit of Microbiota Transfer Therapy on autism symptoms and gut microbiota. Sci. Rep., 9, 5821.
著者紹介Author Profile
 石川 大(いしかわ だい)
石川 大(いしかわ だい)順天堂大学消化器内科細菌叢再生学講座 准教授.博士(医学).
略歴2001年岩手医科大学医学部卒業.04年順天堂大学消化器内科入局.09年米国Case Western Reserve University, IBD Research Center留学.14年順天堂大学消化器内科助教.14年便移植療法の臨床研究開始(研究責任者).16年4月より順天堂大学消化器内科准教授.19年12月よりキリンHD社と共同研究講座「腸内細菌療法研究講座」研究責任者.22年4月よりメタジェンセラピューティクス社と共同研究講座「細菌叢再生学講座」研究責任者.
研究テーマと抱負2014年から潰瘍性大腸炎に対するFMTの臨床研究を開始し,2023年1月から先進医療Bとして承認されました.2020年にメタジェンセラピューティクス社を設立しており,産学連携で患者さんのいち早く届くようにFMTの実装化とその先のマイクロバイオーム創薬を目指していきます.
ウェブサイトhttps://hosp.juntendo.ac.jp/clinic/department/shokaki/about/gastrointestinal/intestinal_microbiota1.html
趣味子供たちとバスケ.