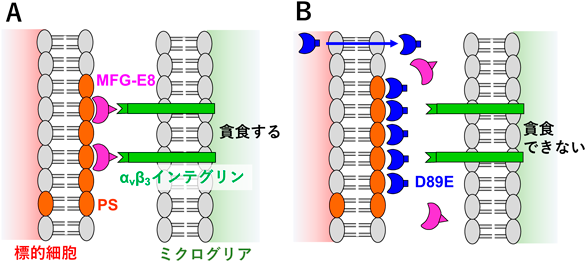
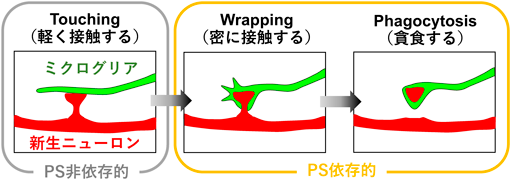
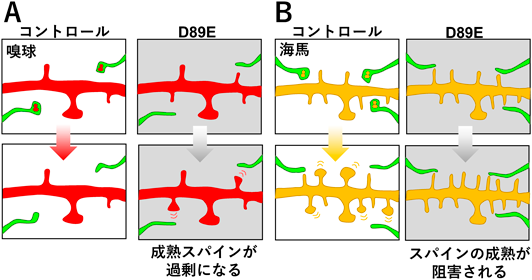
大人の神経細胞を接続する「シナプス」の数を調節するしくみSynaptic pruning of murine adult-born neurons by microglia depends on phosphatidylserine
名古屋市立大学大学院医学研究科脳神経科学研究所神経発達・再生医学分野Department of Developmental and Regenerative Neurobiology, Institute of Brain Science, Nagoya City University Graduate School of Medical Sciences ◇ 〒467–8601 名古屋市瑞穂区瑞穂町字川澄1 ◇ 1 Kawasumi, Mizuho-cho, Mizuho-ku, Nagoya 467–8601, Japan