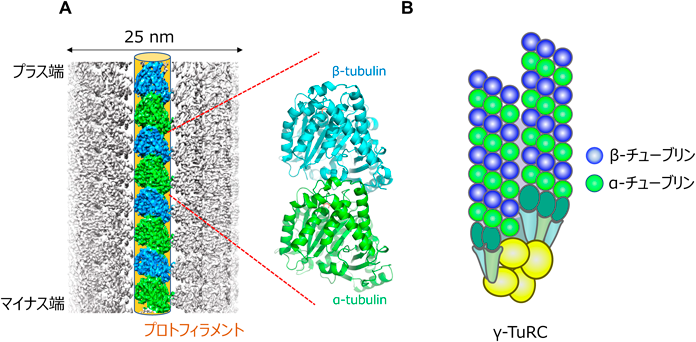
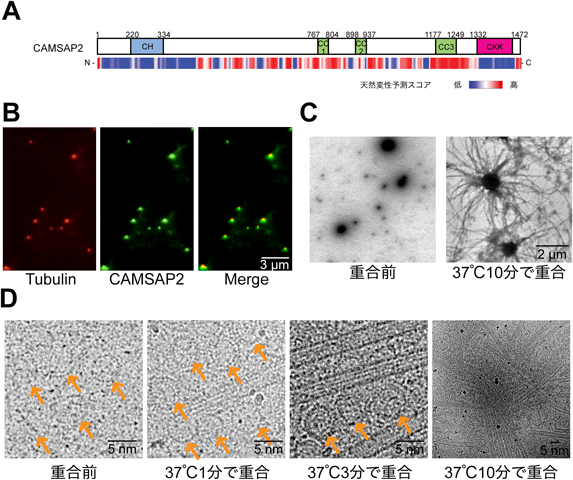
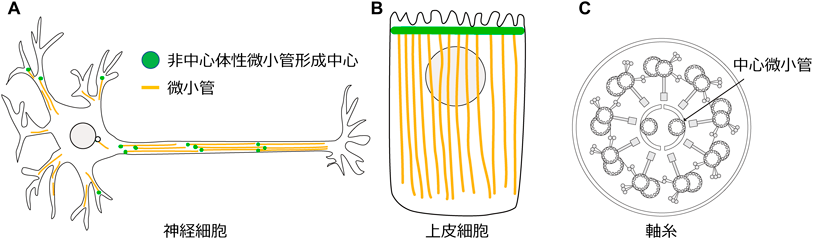
非中心体性微小管形成の分子機構The molecular mechanism of non-centrosomal microtubule nucleation
神戸大学大学院医学研究科 生理学細胞生物学講座 生体構造解剖学分野Division of Structural Medicine and Anatomy, Department of Physiology and Cell Biology, Kobe University Graduate School of Medicine ◇ 〒650–0017兵庫県神戸市中央区楠町7–5–1 ◇ 7–5–1 Kusunoki-cho, Chuo-ku, Kobe, Hyogo 650–0017, Japan