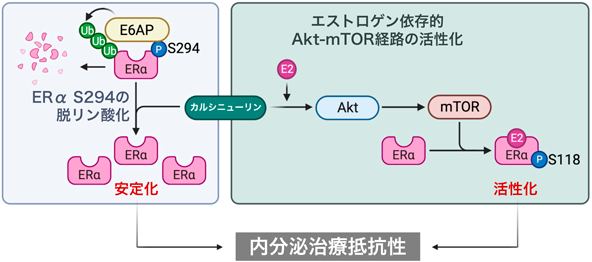
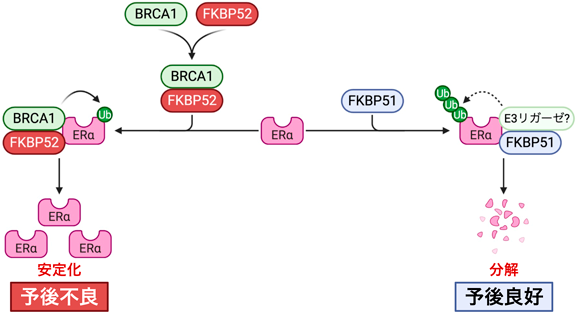
ER陽性乳がんの新規治療法開発に向けたエストロゲン受容体制御メカニズムの解明Decoding estrogen receptor regulation to develop novel therapies for ER-positive breast cancer
山口大学共同獣医学部Joint Faculty of Veterinary Medicine, Yamaguchi University ◇ 〒753–8515 山口県山口市吉田1677–1農学部・共同獣医学部棟209 ◇ 1677–1 Yoshida, Yamaguchi, Yamaguchi, 753–8515, Japan