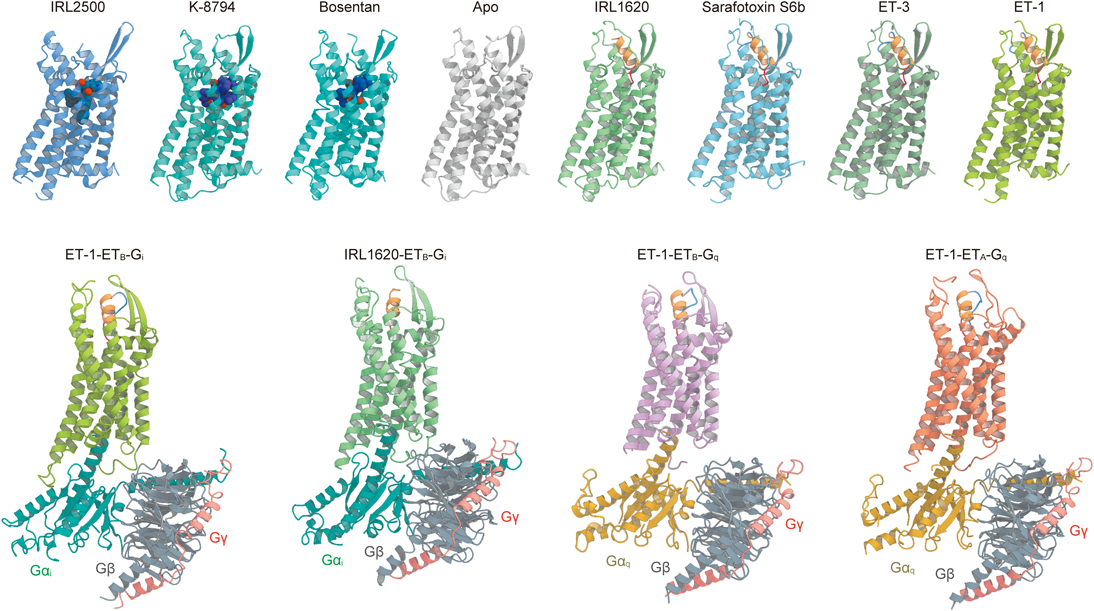
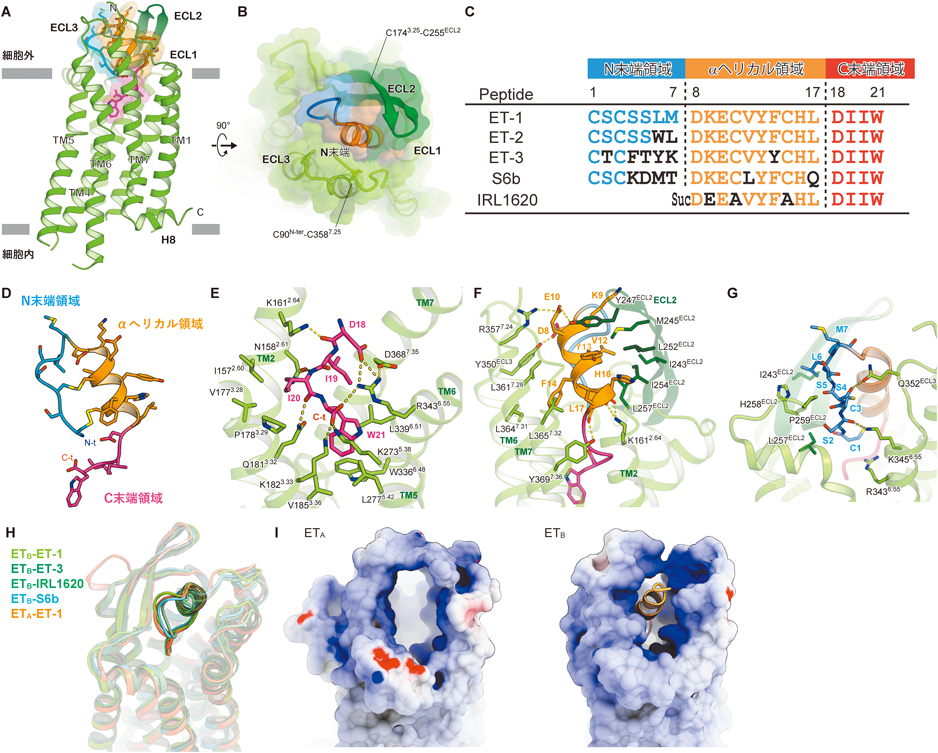
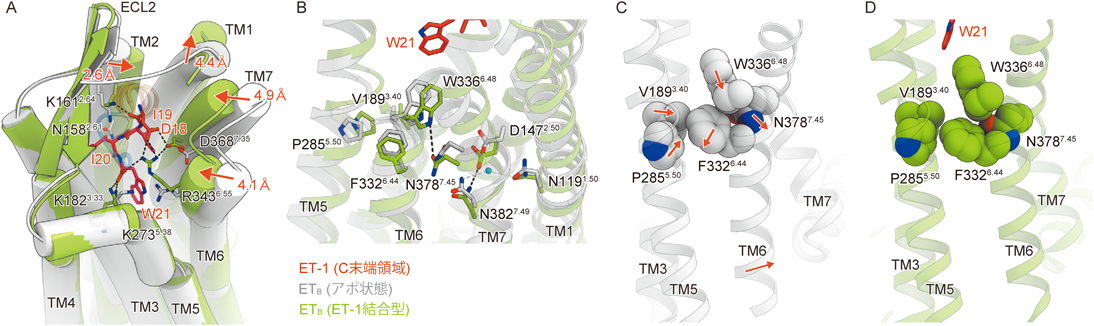
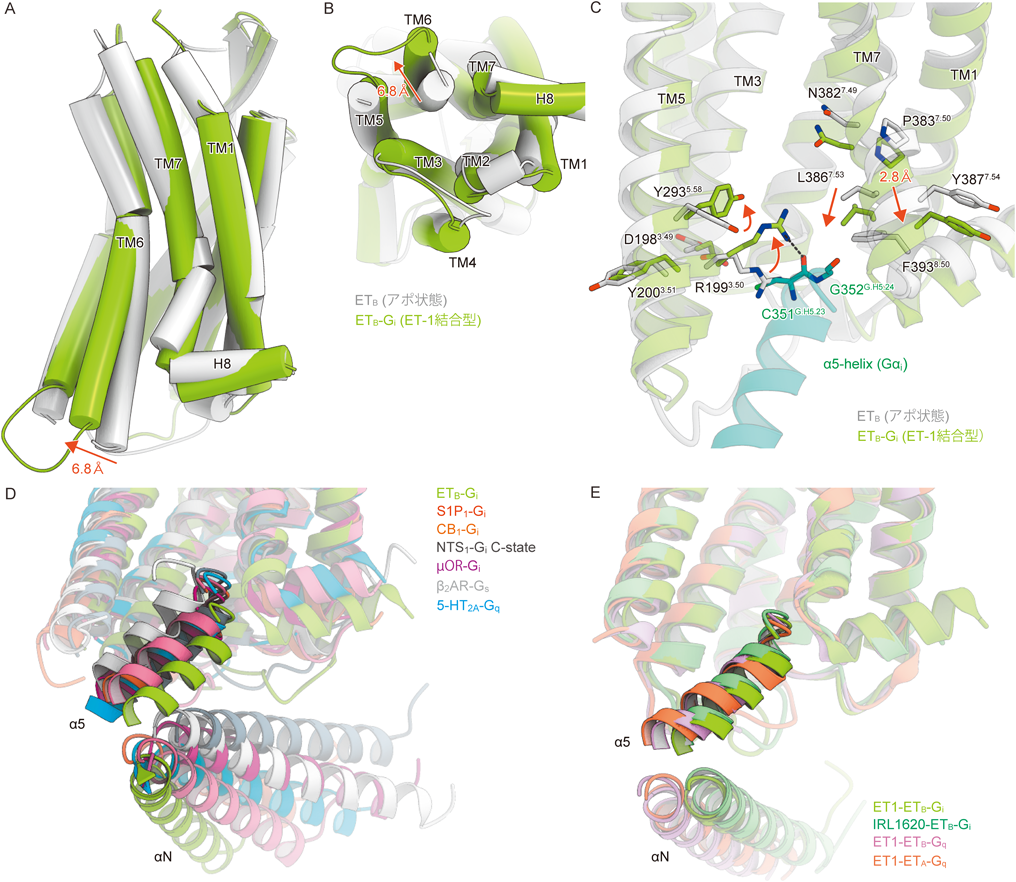
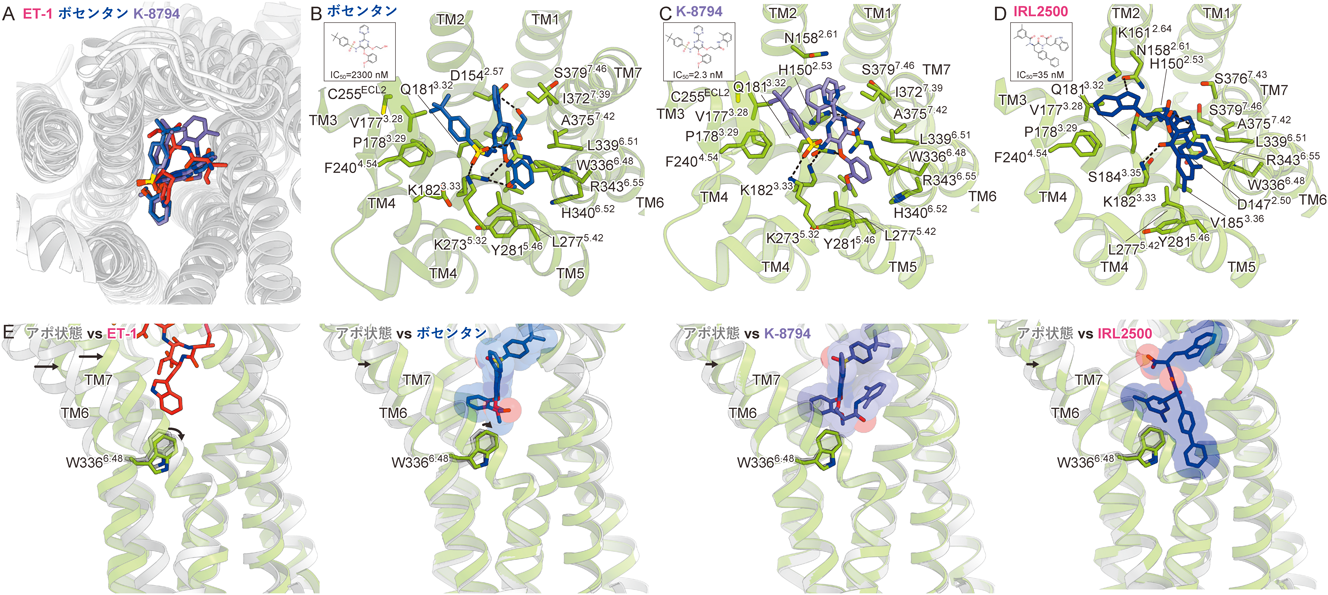
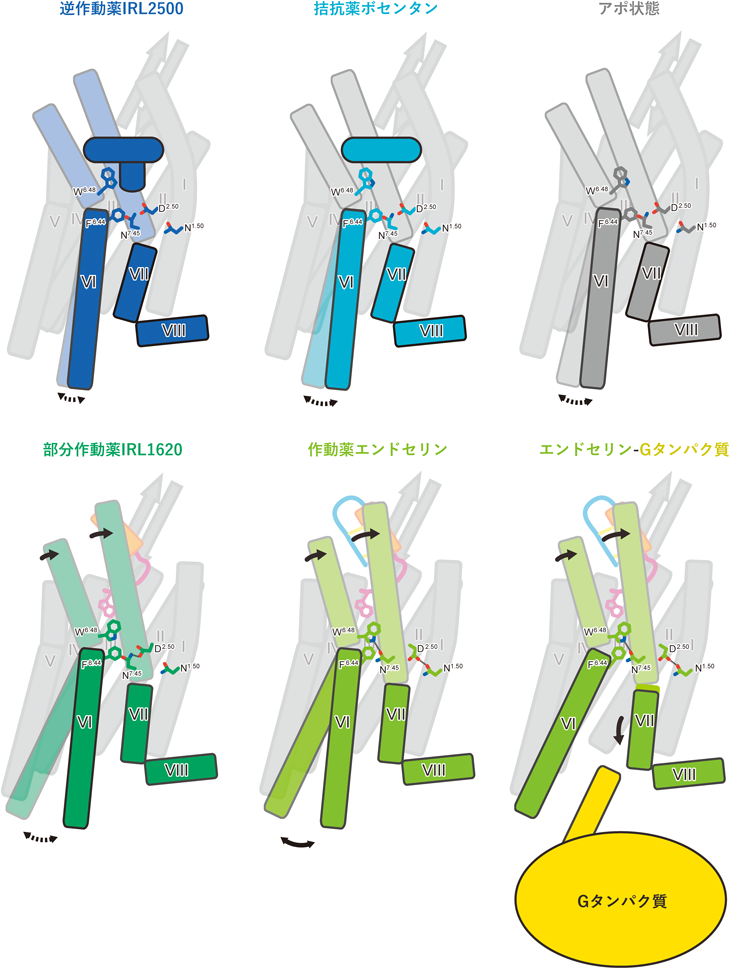
最新技術で明らかになったエンドセリン受容体の構造と機能Structure and function of endothelin receptors revealed by state-of-the-art technology
東京大学大学院理学系研究科生物科学専攻Department of Biological Sciences, Graduate School of Science, The University of Tokyo ◇ 〒113–0033 東京都文京区本郷7–3–1 東京大学理学部1号館東棟583 ◇ East Wing 583, Building 1, Faculty of Science, The University of Tokyo, 7–3–1 Hongo, Bunkyo-ku, Tokyo 113–0033, Japan