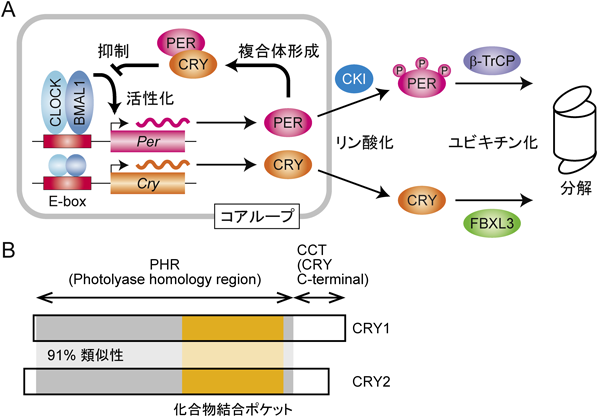
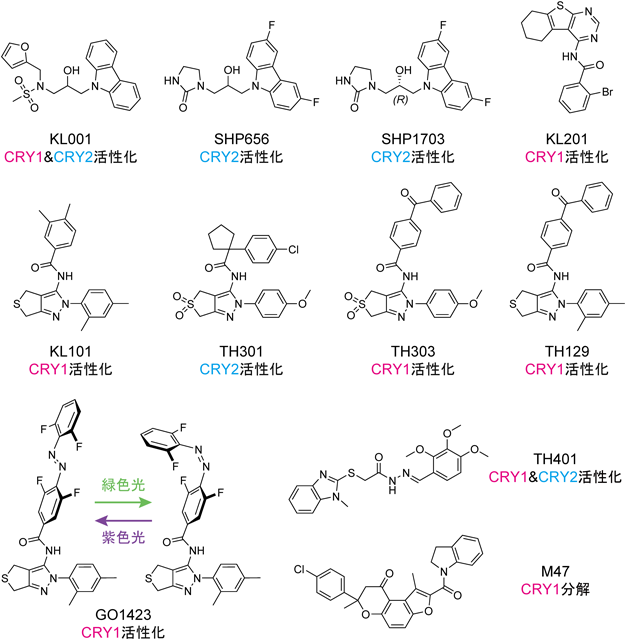
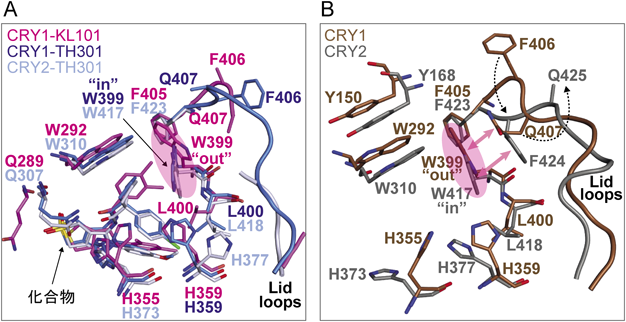
概日時計タンパク質CRY1とCRY2をアイソフォーム選択的に制御する化合物Isoform-selective compounds against mammalian circadian clock proteins CRY1 and CRY2
名古屋大学トランスフォーマティブ生命分子研究所Institute of Transformative Bio-Molecules, Nagoya University ◇ 〒464–8601 愛知県名古屋市千種区不老町 ◇ Furo-cho, Chikusa-ku, Nagoya, Aichi 464–8601, Japan