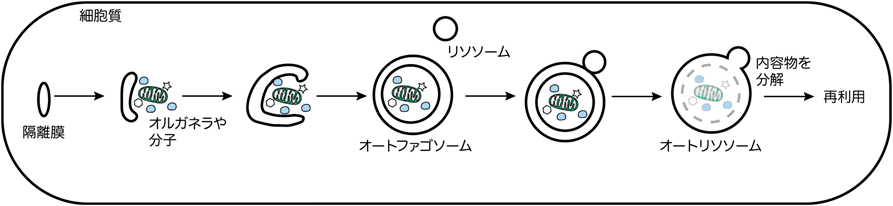
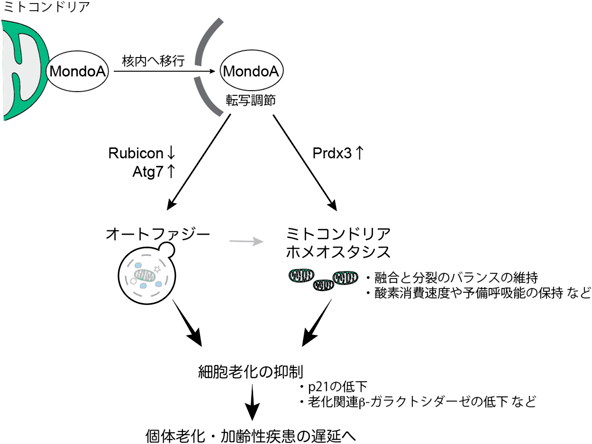
オートファジーによる細胞老化制御機構MondoA decelerates cellular senescence by retaining autophagy and mitochondrial homeostasis
1 大阪大学大学院医学系研究科生化学・分子生物学講座遺伝学教室Department of Genetics, Graduate School of Medicine, Osaka University ◇ 〒565–0871 大阪府吹田市山田丘2–2 ◇ 2–2 Yamadaoka, Suita, Osaka 565–0871, Japan
2 大阪大学大学院生命機能研究科時空生物学講座細胞内膜動態研究室Laboratory of Intracellular Membrane Dynamics, Graduate School of Frontier Biosciences ◇ 〒565–0871 大阪府吹田市山田丘2–2 ◇ 2–2 Yamadaoka, Suita, Osaka 565–0871, Japan
3 奈良県立医科大学生化学講座Department of Biochemistry, Nara Medical University ◇ 〒634–8521 奈良県橿原市四条町840番地 ◇ 840 Shijo-cho, Kashihara, Nara 634–8521, Japan