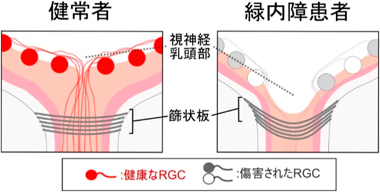
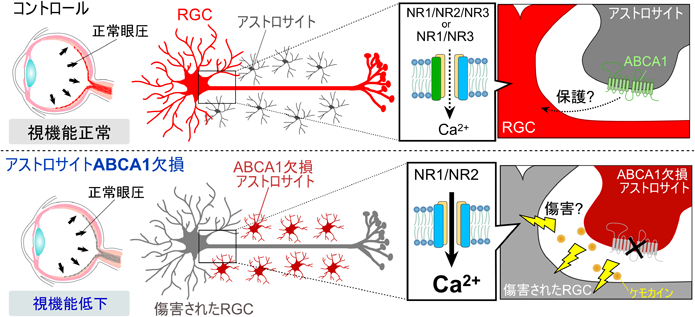
アストロサイトの機能異常による正常眼圧緑内障発症機構Astrocyte dysfunction-induced pathogenesis of normal-tension glaucoma
1 東京都医学総合研究所視覚病態プロジェクトVisual Research Project, Tokyo Metropolitan Institute of Medical Science ◇ 〒156–8506 東京都世田谷区上北沢2–1–6 ◇ 2–1–6 Kamikitazawa, Setagaya-ku, Tokyo 156–8506, Japan
2 山梨大学GLIAセンターGLIA center, University of Yamanashi ◇ 〒409–3898 山梨県中央市下河東1110 ◇ 1110 Shimokato, Chuo, Yamanashi 409–3898, Japan
3 山梨大学大学院総合研究部医学域薬理学講座Department of Neuropharmacology, Interdisciplinary Graduate School of Medicine, University of Yamanashi ◇ 〒409–3898 山梨県中央市下河東1110 ◇ 1110 Shimokato, Chuo, Yamanashi 409–3898, Japan