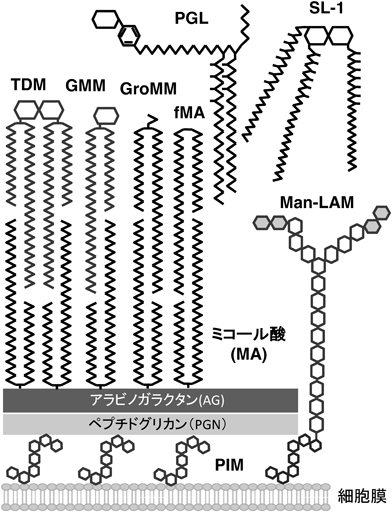
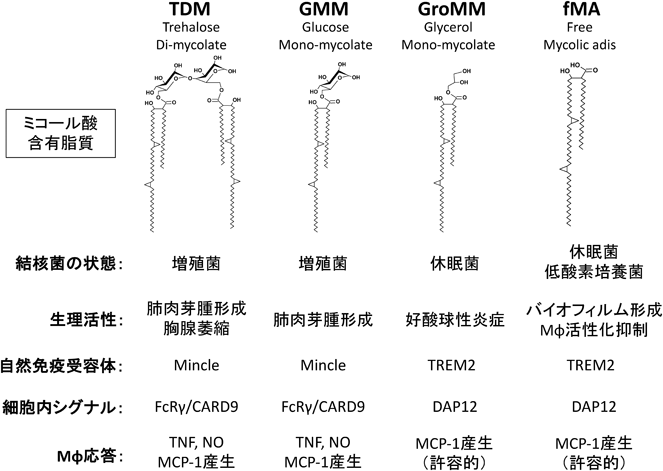
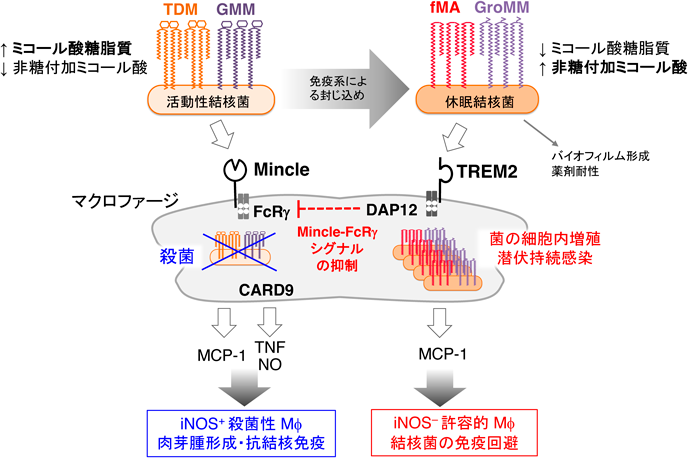
結核菌による宿主自然免疫応答の制御Control of host innate immunity by Mycobacterium tuberculosis
鹿児島大学大学院医歯学総合研究科免疫学分野Department of Immunology, Kagoshima University Graduate School of Medical and Dental Sciences ◇ 〒890–8544 鹿児島市桜ヶ丘8–35–1 ◇ 8–35–1 Sakuragaoka, Kagoshima-city, Kagoshima 890–8544, Japan