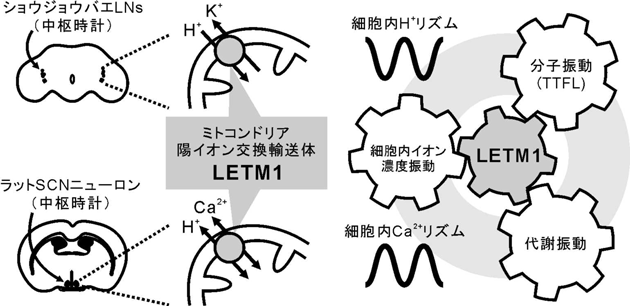
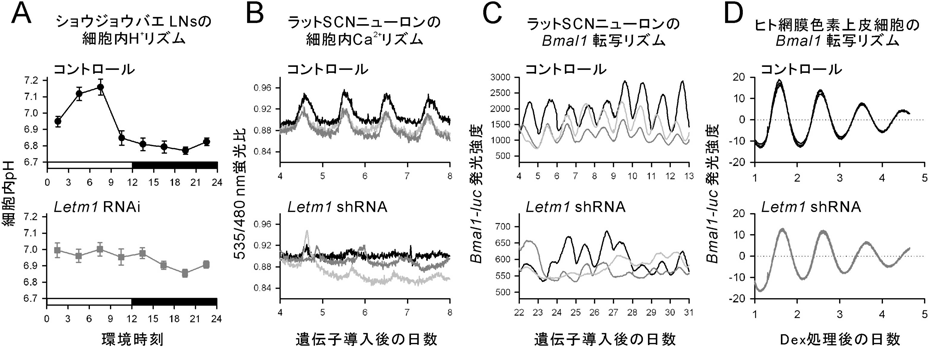
ミトコンドリア陽イオントランスポーターによる体内時計ニューロンの普遍的制御Mitochondrial cation transporter regulates molecular clock rhythms in circadian pacemaker neurons
富山大学学術研究部理学系Graduate School of Science and Engineering, University of Toyama ◇ 〒930–8555 富山県富山市五福3190 ◇ 3190 Gofuku, Toyama-shi, Toyama 930–8555, Japan