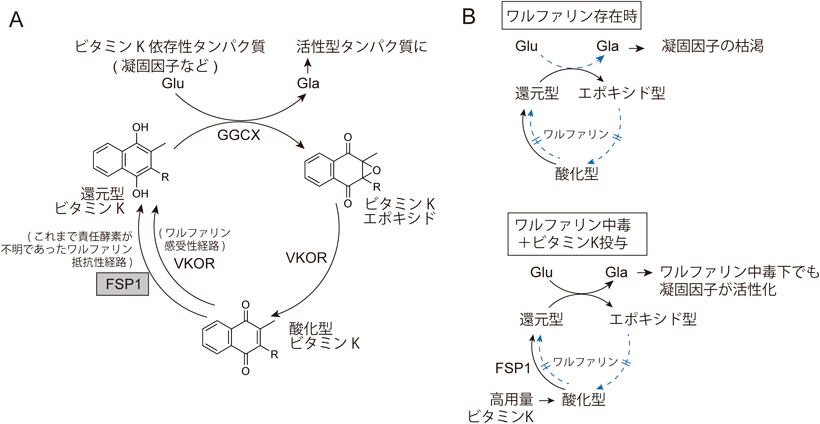
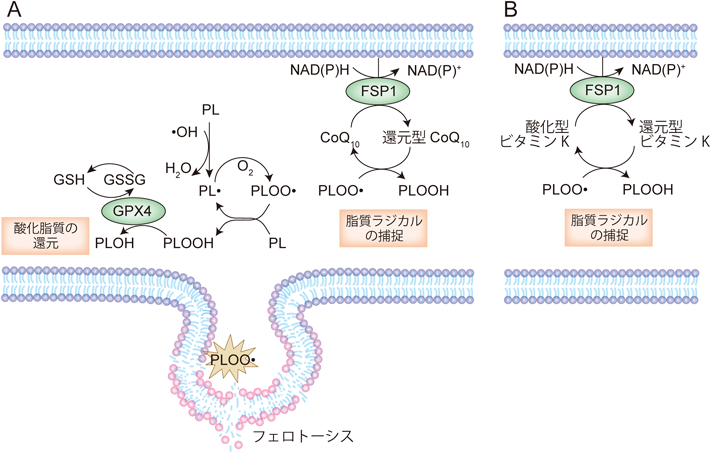
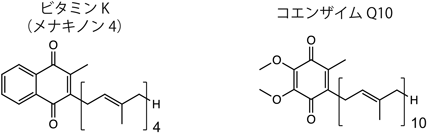
ビタミンKのフェロトーシス抑制作用とビタミンK還元酵素の同定Ferroptosis suppression via vitamin K reduction
1 ヘルムホルツセンターミュンヘン 上級研究員Helmholtz Munich ◇ Ingolstädter Landstr. 1, 85764, Neuherberg, Germany ◇ Ingolstädter Landstr. 1, 85764, Neuherberg, Germany
2 東北大学大学院医学系研究科腎膠原病内分泌学分野非常勤講師Tohoku University Graduate School of Medicine ◇ 〒980–8574 宮城県仙台市青葉区星陵町1–1 ◇ 1–1 Seiryo-cho, Aoba-ku, Sendai, Miyagi 980–8574, Japan