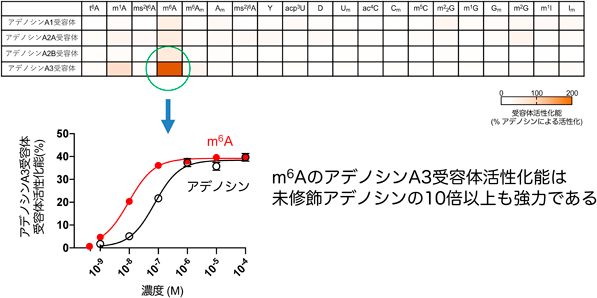
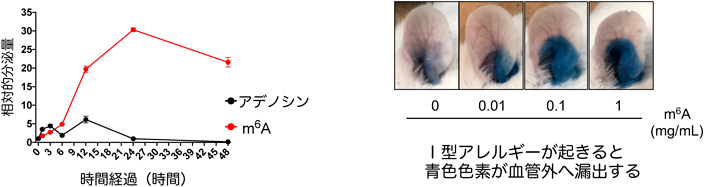
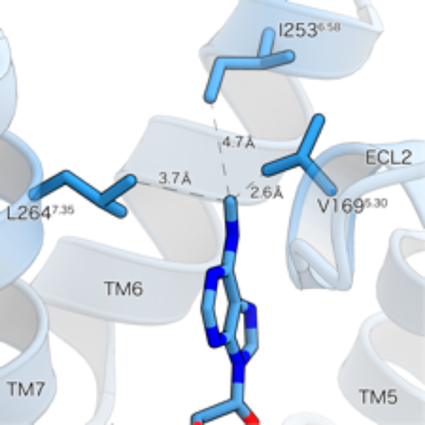
修飾RNAによる免疫制御リガンドとしての作用Modified RNA catabolites act as immunoregulatory ligands
東北大学加齢医学研究所モドミクス医学分野Department of Modomics Biology and Medicine, Institute of Development, Aging and Cancer (IDAC), Tohoku University ◇ 〒980–8575 宮城県仙台市青葉区星陵町4–1 ◇ 4–1 Seiryo-Machi, Aoba-Ku, Sendai, Miyagi 980–8575, Japan