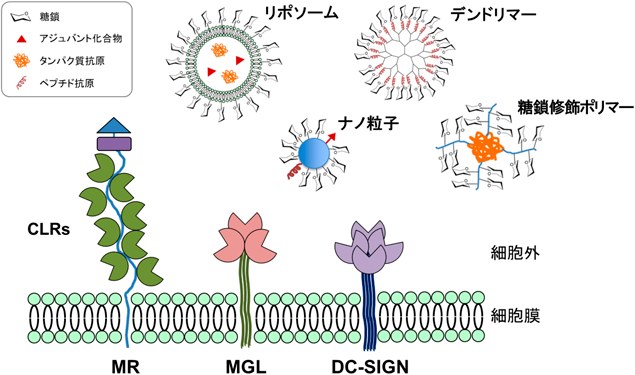
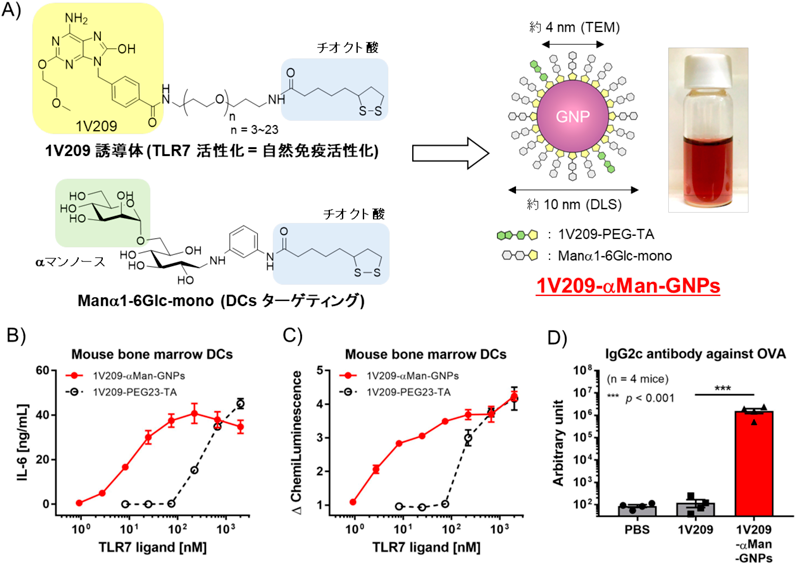
抗原提示細胞表層のC型レクチン受容体を標的とする糖鎖を用いたドラッグデリバリーシステムSugar chain based drug delivery system for targeting C-type lectin receptors on antigen presenting cells
1 鹿児島大学大学院理工学研究科工学専攻化学生命工学プログラムDepartment of Engineering, Chemistry and Biotechnology Program, Graduate School of Science and Engineering, Kagoshima University ◇ 〒890–0065 鹿児島県鹿児島市郡元1–21–40 ◇ Korimoto 1–21–40, Kagoshima, Kagoshima 890–0065, Japan
2 鹿児島大学大学院理工学研究科糖鎖ナノテクノロジー共同研究講座Collaborative Research Laboratory on Glyco-nanotechnology, Graduate School of Science and Engineering, Kagoshima University ◇ 〒890–0065 鹿児島県鹿児島市郡元1–21–40 ◇ Korimoto 1–21–40, Kagoshima, Kagoshima 890–0065, Japan