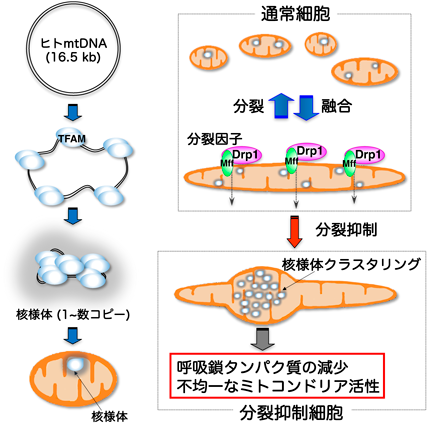
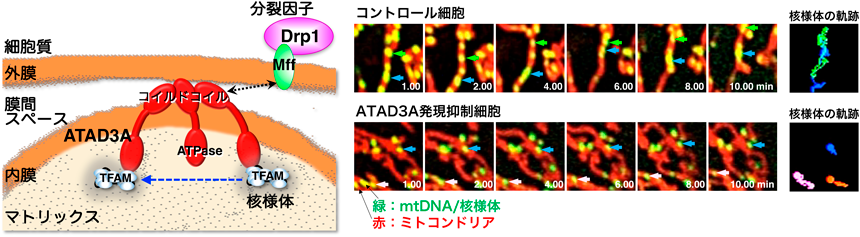
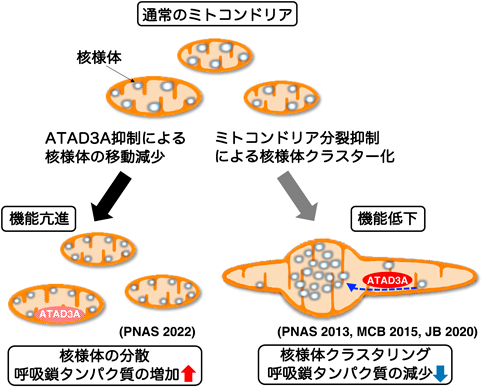
ミトコンドリアゲノムの新しい制御機構:核様体のダイナミクスとその意義Dynamics of mitochondrial nucleoids as a novel regulatory mechanism of the mitochondrial genome
1 大阪大学大学院理学研究科生物科学専攻Department of Biological Sciences, Graduate School of Science, Osaka University ◇ 〒560–0043 大阪府豊中市待兼山町1–1 ◇ 1–1 Machikaneyama-cho, Toyonaka, Osaka 560–0043, Japan
2 島根大学医学部生命科学講座Department of Life Science, Faculty of Medicine, Shimane University ◇ 〒693–8501 島根県出雲市塩冶町89–1 ◇ 89–1 Enya-cho, Izumo, Shimane 693–8501, Japan