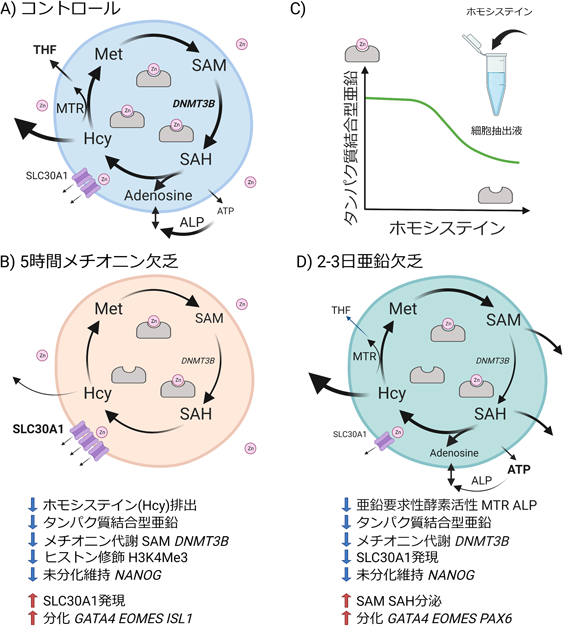
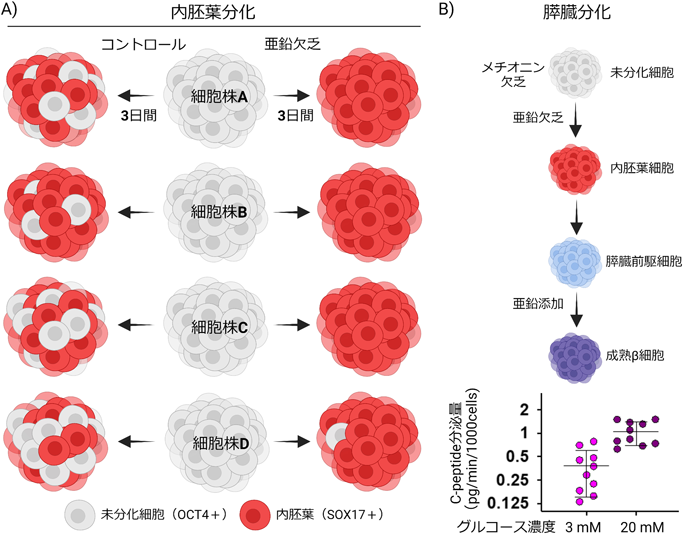
メチオニンと亜鉛は多能性幹細胞の多能性および分化を制御するMethionine and zinc regulate pluripotency and differentiation of pluripotent stem cells
東京工業大学生命理工学院School of Life Science and Technology, Tokyo Institute of Technology ◇ 〒226–8501 神奈川県横浜市緑区長津田町4259 B32 ◇ 4259 B32 Nagatsuta-cho, Midori-ku, Yokohama, Kanagawa 226–8501, Japan