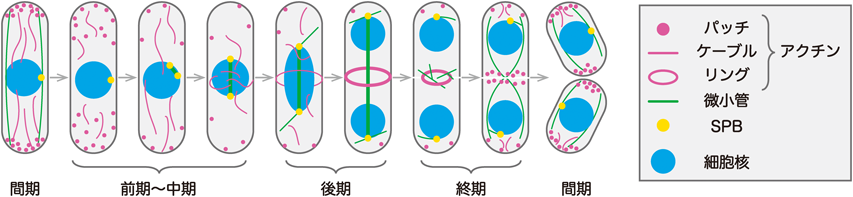
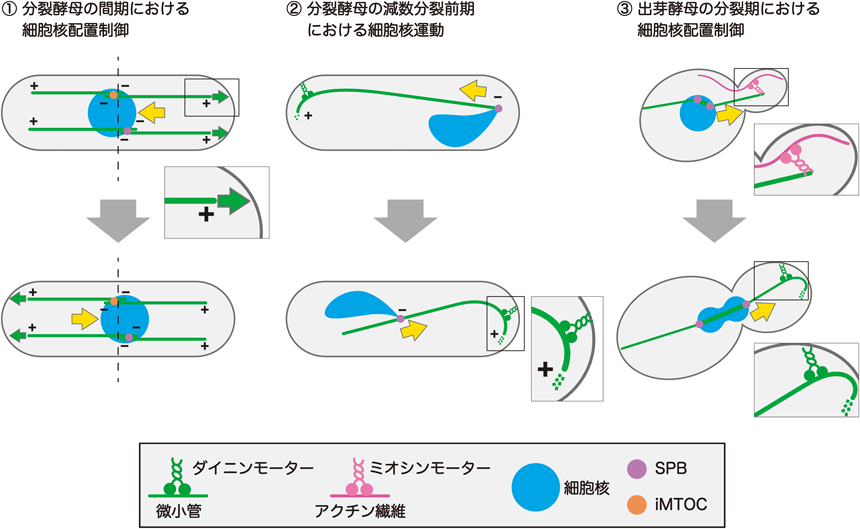
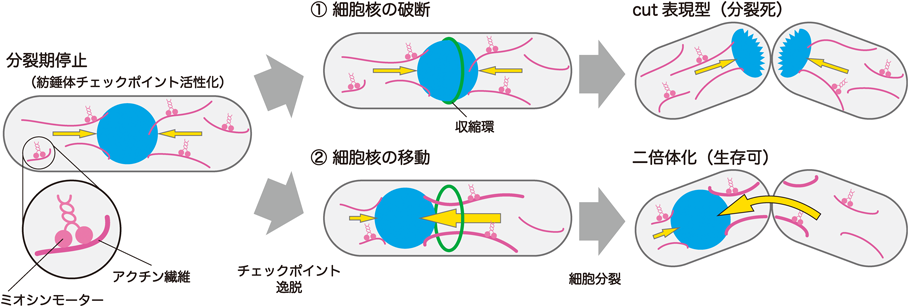
分裂期細胞核の細胞内配置決定に関わる新たな経路A novel pathway involved in mitotic nuclear positioning in fission yeast
広島大学大学院統合生命科学研究科Graduate School of Integrated Sciences for Life, Hiroshima University ◇ 〒739–8530 広島県東広島市鏡山1–3–1 ◇ 1–3–1 Kagamiyama, Higashi-Hiroshima, Hiroshima 739–8530, Japan