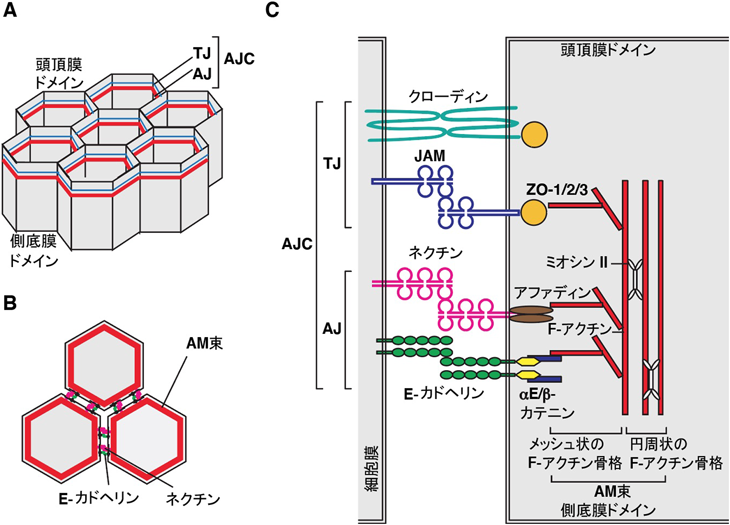
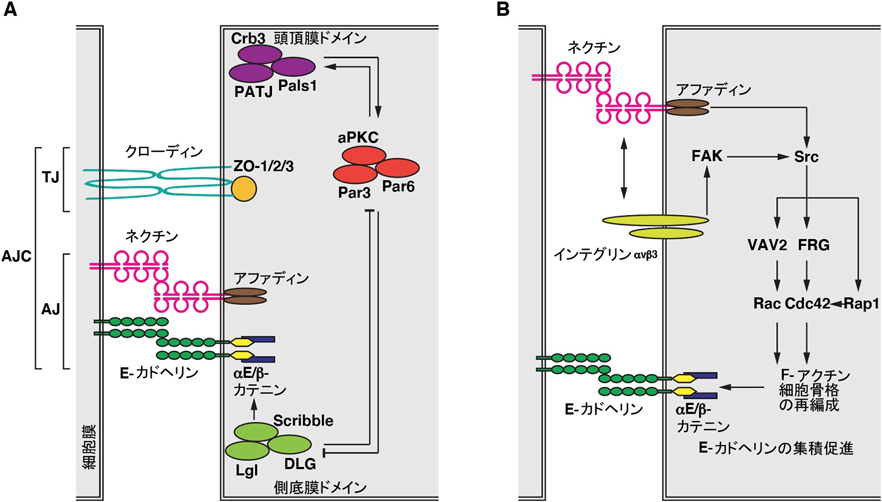
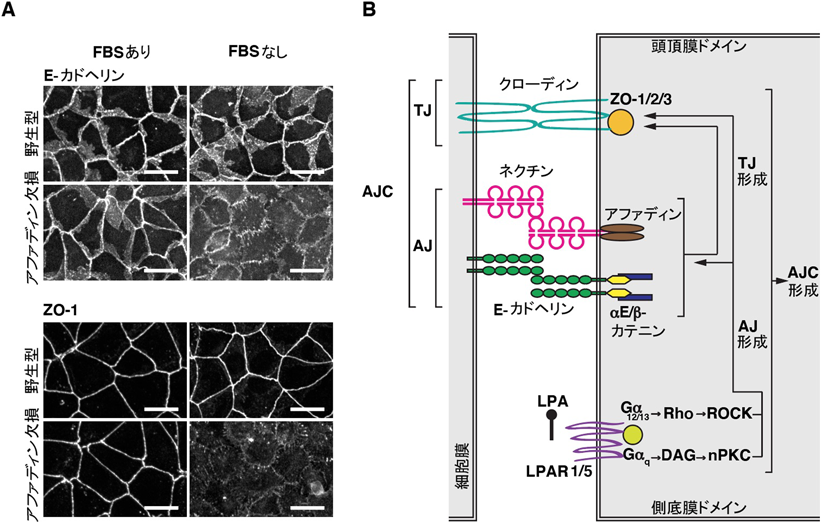
上皮細胞の細胞間接着におけるリゾホスファチジン酸の機能と作用機構Function and mechanism of action of lysophosphatidic acid in promoting epithelial apical junctional complex organization
1 徳島大学大学院医学研究科生化学分野Department of Biochemistry, Tokushima University Graduate School of Medicine ◇ 〒770–8503 徳島市蔵本町3丁目18–15 ◇ 3–18–15 Kuramoto-cho, Tokushima 770–8503, Japan
2 神戸大学大学院医学研究科病態シグナル学部門Division of Pathogenetic Signaling, Department of Biochemistry and Molecular Biology, Kobe University Graduate School of Medicine ◇ 〒650–0047 神戸市中央区港島南町1丁目5–6 ◇ 1–5–6 Minatojimaminami-machi, Chuo-ku, Kobe 650–0047, Japan
3 徳島大学ポストLEDフォトニクス研究所医光融合研究部門Department of Interdisciplinary Researches for Medicine and Photonics, Institute of Post-LED Photonics, Tokushima University ◇ 〒770–8506 徳島県徳島市南常三島町2丁目1 ◇ 2–1 Minamijosanjima-cho, Tokushima 770–8506, Japan
4 徳島大学先端酵素学研究所病態シグナル学分野Division of Pathogenetic Signaling, Institute of Advanced Medical Sciences, Tokushima, Japan ◇ 〒770–8503 徳島市蔵本町3丁目18–15 ◇ 3–18–15 Kuramoto-cho, Tokushima 770–8503, Japan