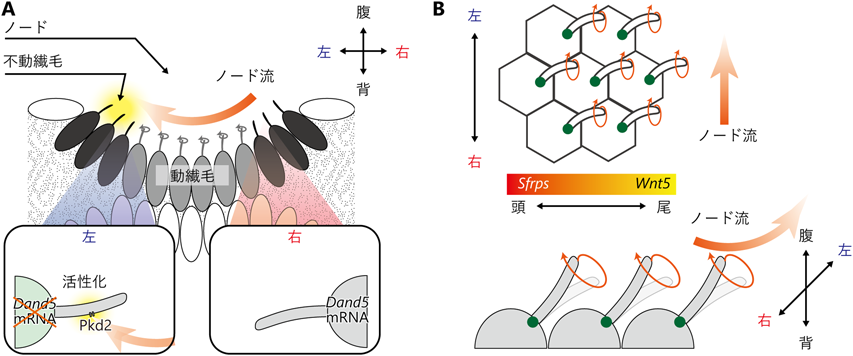
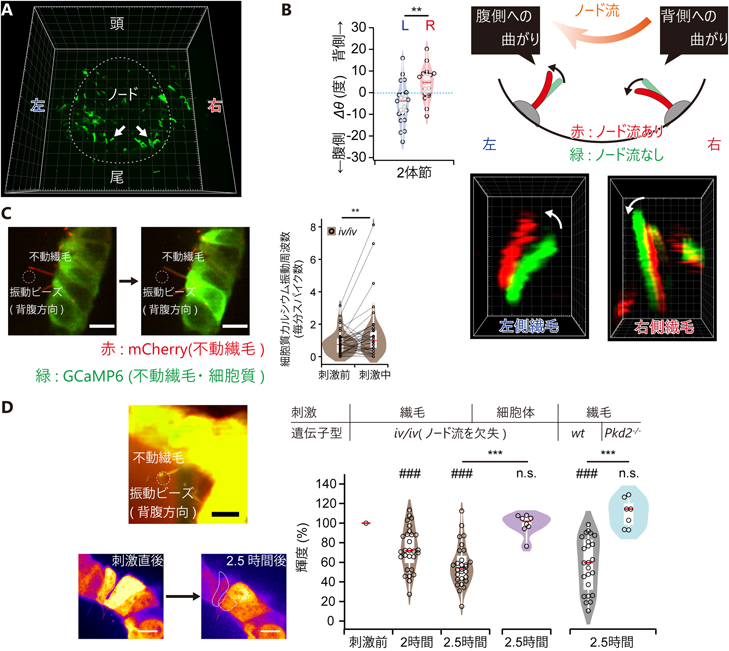
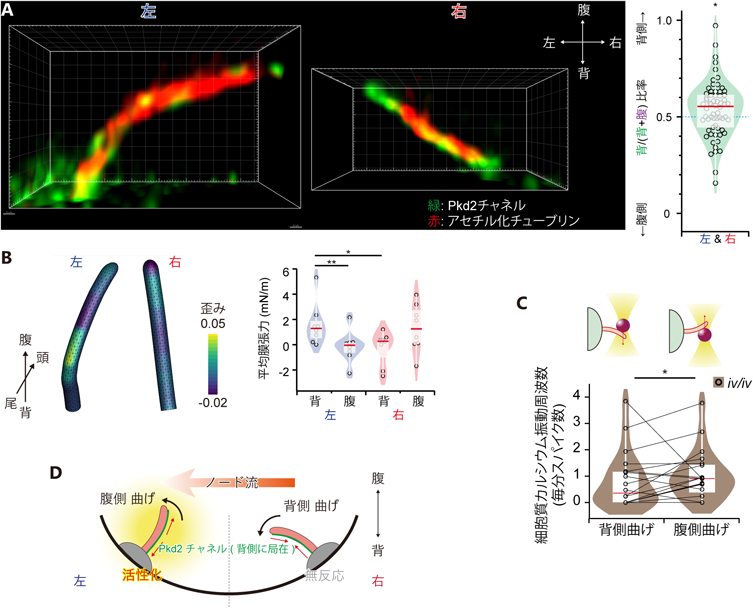
からだの左右軸決定におけるノード繊毛の機能:背腹・頭尾軸の情報を利用して左右を決定する巧妙な仕組みMouse nodal immotile cilia sense bending direction for left–right determination: Symmetry breaking mechanism using the information of dorso–ventral and antero–posterior axes
東京大学大学院医学系研究科細胞生物学教室Department of Cell Biology, Graduate School of Medicine, The University of Tokyo ◇ 〒113–0033 東京都文京区本郷7–3–1 医学部教育研究棟3階北側 ◇ Med.Res.Bldg., 3F-North, 7–3–1 Hongo, Bunkyo-ku, Tokyo 113–0033, Japan