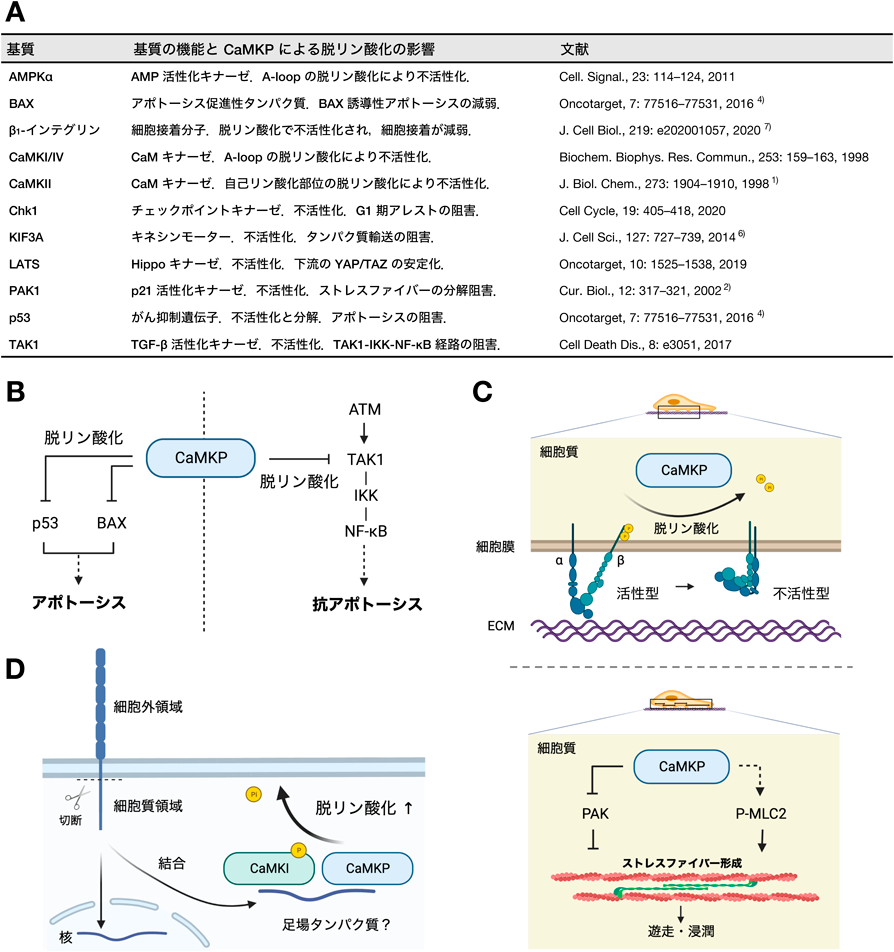
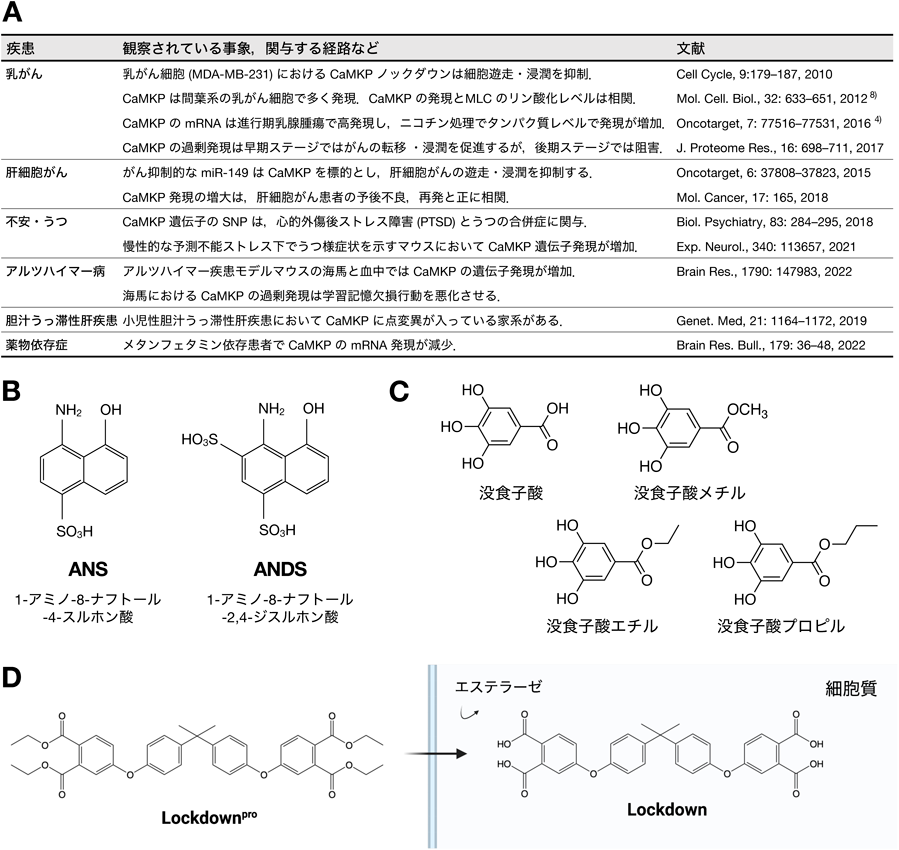
CaMKホスファターゼの多様な生理機能とその阻害剤研究Diverse physiological functions of CaMK phosphatase and studies on its inhibitors
1 ヴァンダービルト大学医学部基礎科学School of Medicine Basic Science, Vanderbilt University ◇ TN37232–2175 アメリカテネシー州ナッシュビル465 21st Ave S. ◇ 465 21st Ave S., Nashville, TN37232–2175, USA
2 広島大学大学院統合生命科学研究科Graduate School of Integrated Sciences for Life, Hiroshima University ◇ 〒739–8521 広島県東広島市鏡山1–7–1 ◇ 1–7–1 Kagamiyama, Higashi-Hiroshima, Hiroshima 739–8521, Japan
3 香川大学農学部Faculty of Agriculture, Kagawa University ◇ 〒761–0795 香川県木田郡三木町池戸2393 ◇ 2393 Ikenobe, Kita-gun, Miki-cho, Kagawa 761–0795, Japan