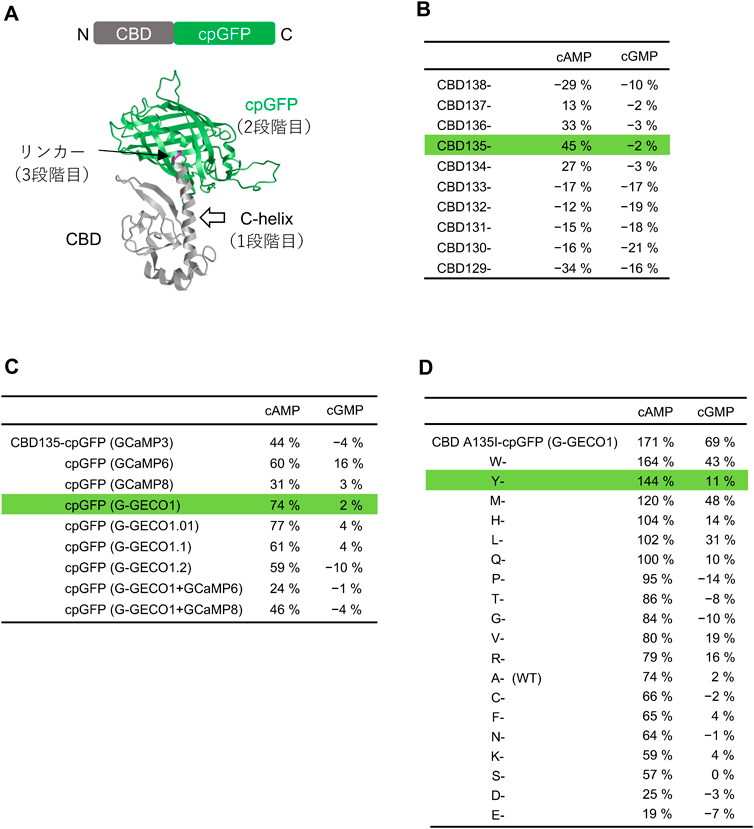
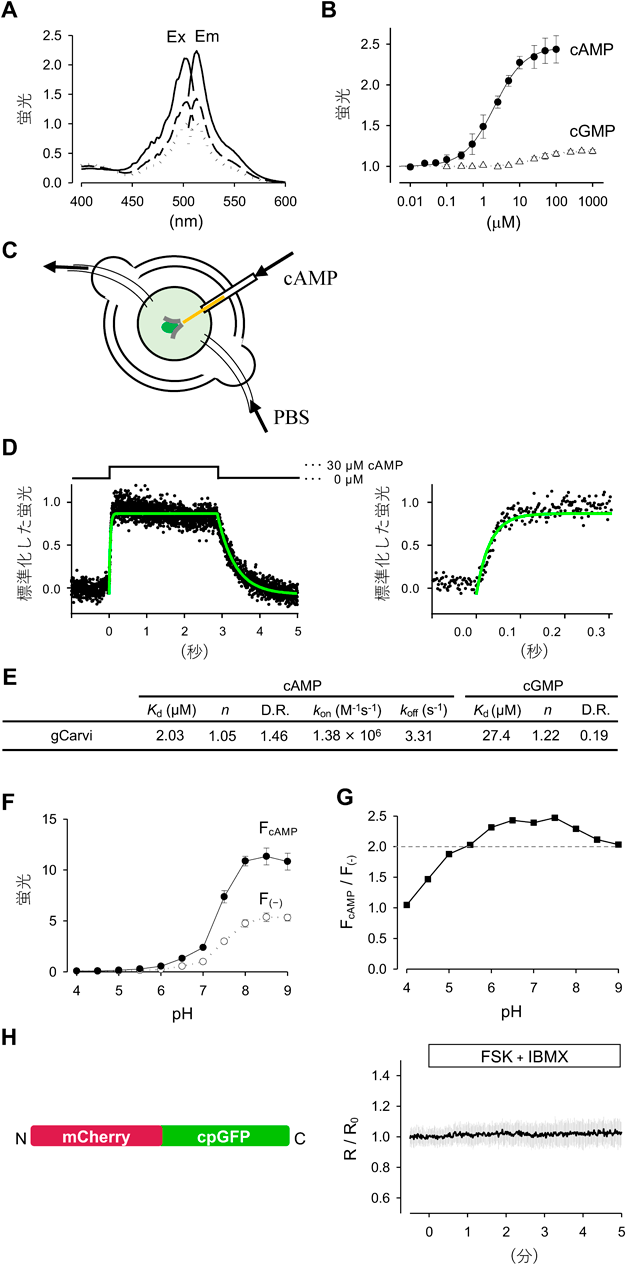
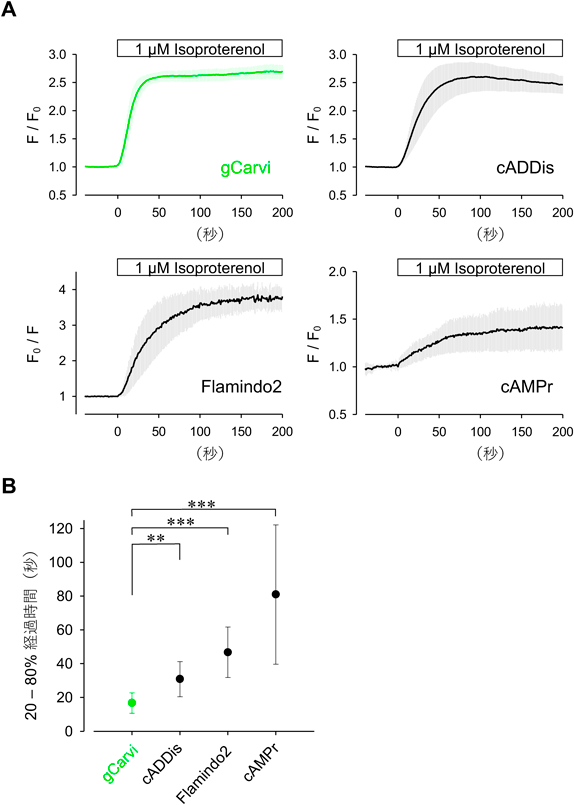
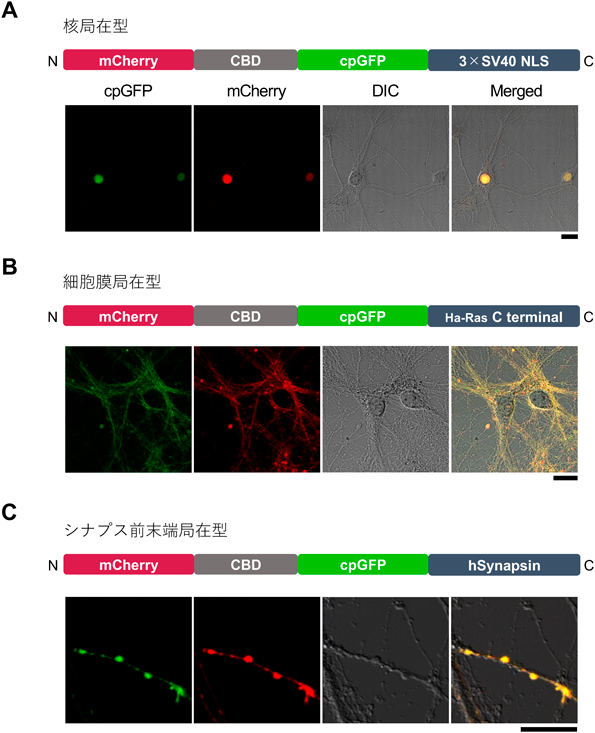
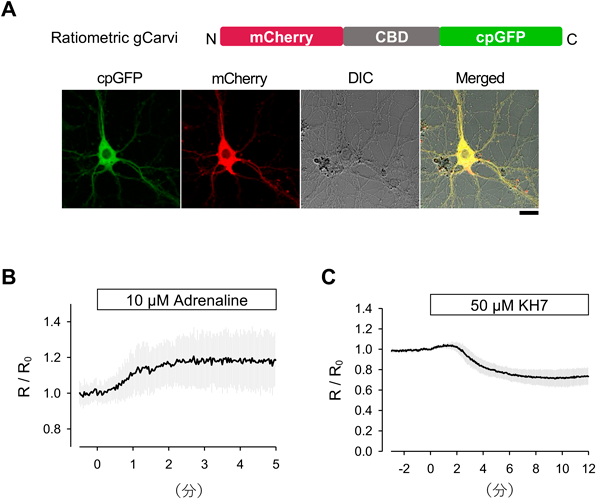
神経細胞内cAMPイメージングを可能にする,特異的かつ高速な蛍光プローブの開発Development of a high-speed and specific fluorescent probe for neuronal cAMP imaging
同志社大学生命医科学研究科神経生理学Department of Neurophysiology, Graduate School of Life and Medical Sciences, Doshisha University ◇ 〒610–0394 京都府京田辺市多々羅都谷1–3 ◇ 1–3 Tataramiyakodani, Kyotanabe, Kyoto 610–0394, Japan