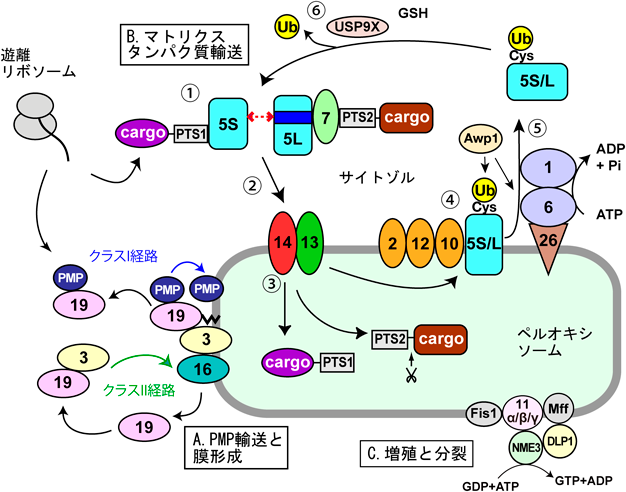
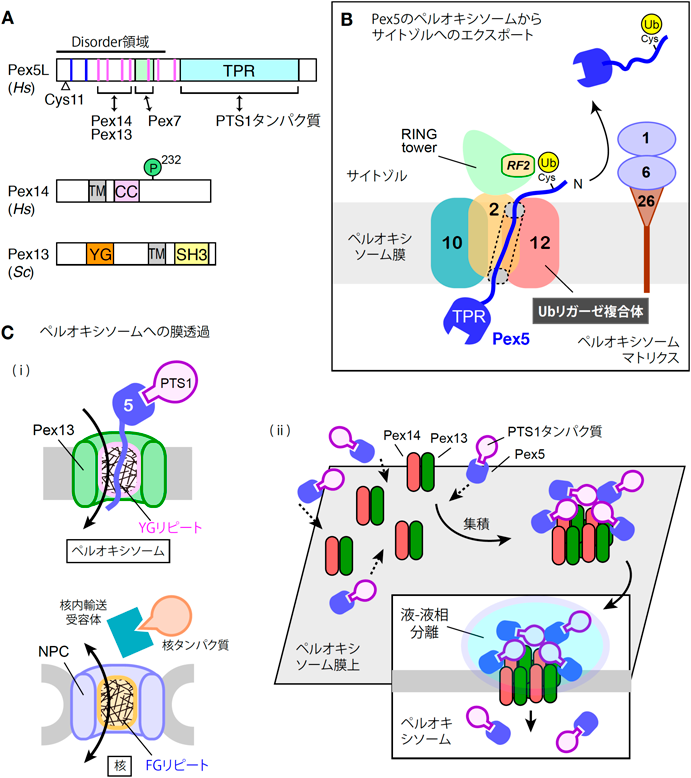
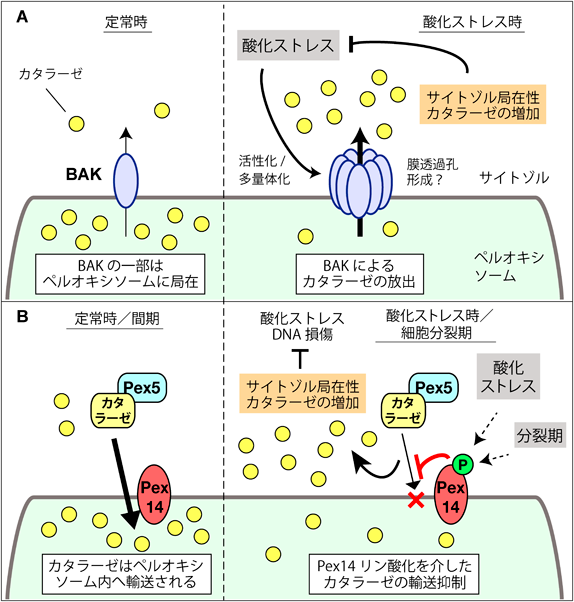
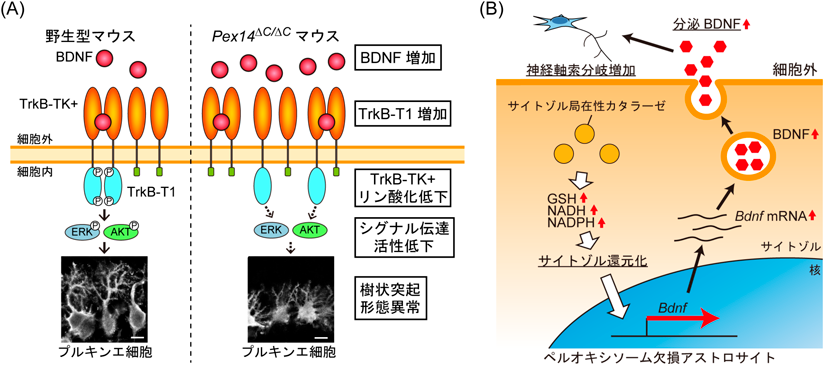
ペルオキシソームの動態と機能制御研究の新展開Recent advances in research on the dynamics and functional regulation of peroxisome
1 九州大学理学研究院生物科学部門Department of of Biology, Graduate School of Sciences, Kyushu University ◇ 〒819–0053 福岡市西区元岡744 ◇ 744 Motooka, Nishi-ku, Fukuoka 819–0053, Japan
2 崇城大学生物生命学部生物生命学科Department of Biotechnology and Life Sciences, Faculty of Biotechnology and Life Sciences, Sojo University ◇ 〒860–0082 熊本市西区池田4–22–1 ◇ 4–22–1 Ikeda, Nishi-ku, Kumamoto 860–0082, Japan
3 九州大学基幹教育院Faculty of Arts and Sciences, Kyushu University ◇ 〒819–0053 福岡市西区元岡744 ◇ 744 Motooka, Nishi-ku, Fukuoka 819–0053, Japan
4 レオロジー機能食品研究所Institute of Rheological Functions of Food ◇ 〒811–2501 福岡県糟屋郡久山町久原2241–1 ◇ 2241–1 Kuhara, Hisayama-cho, Fukuoka 811–2501, Japan
5 兵庫県立大学理学研究院生命科学専攻School of Sciences, University of Hyogo ◇ 〒678–1297 兵庫県赤穂郡上郡町光都3–2–1 ◇ 3–2–1 Koto, Kamigori-cho, Hyogo 678–1297, Japan