1898年にイタリアの医師兼科学者カミロ・ゴルジは,染色手法を用いて神経細胞内に特異的な膜構造を発見しこれを内部網様体(internal reticular apparatus)と名づけた1).しかし,この構造が後にゴルジ体と命名されるまで長い期間にわたってその存在は疑問視され,最終的には電子顕微鏡によって確認された2).
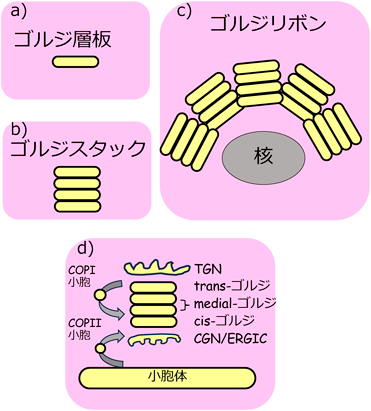
現在一般的に認知されているゴルジ体の構造については,層板[cisterna(e)]と呼ばれる平らな袋状の膜構造が積み重なって形成されるゴルジスタックというパンケーキ状の構造を基本とする3).一つのゴルジスタックは通常4~8個の層板で構成される.教科書などでは通常ゴルジスタックは1~数個のみが描かれているが,実際には細胞や生物種によって異なるものの,一つの細胞は数個から100個のゴルジスタックを有する4).これらのゴルジスタックは,多くの場合横方向に連結してゴルジリボンと呼ばれるリボン状の構造を形成する5)(関連名称等を図1に示した).なお,ゴルジ体は,英語でも日本語でも略されてゴルジと称されることが多い.
このゴルジリボンはノコダゾール等の微小管重合阻害剤によって壊され,ミニゴルジスタック(微小管破壊により生じるゴルジスタック)として細胞内に分散する4).ゴルジリボンやゴルジスタックの生物学的意義については,いまだ多くの不明点が存在する.たとえば,酵母Saccharomyces cerevisiaeはゴルジリボンやゴルジスタックを持っていないが,化学修飾や分泌などの基本的な機能は行っている.このことから,ゴルジリボンやゴルジスタックが持つ化学修飾や分泌以外の機能の存在が示唆される.
さらに,ゴルジスタックの構造はGRASP65とGRASP55というゴルジ体積層タンパク質によって形成されるトランスオリゴマーを介して維持されると長らく考えられてきた6).RNA干渉などでこれらのGRASPタンパク質を除去すると,ゴルジ体スタックの構造が壊れ,ゴルジ体の機能である正確な糖鎖修飾と仕分けが損なわれることが報告されている7).ところが,最近の研究ではGRASPを特異的なタンパク質分解法で除去した結果,これらのタンパク質はスタック構造の維持よりもゴルジスタックの横方向の連結に主に関与する可能性が示された8).この新たな認識は,スタック状のゴルジ体を持たないS. cerevisiaeがGRASPのホモログであるGrh1を発現している事実によっても支持されるかもしれない9, 10).
余談となるが,マイクロ流路技術を用いた液滴形成においては,流速を制御することで液滴の形状を球形から層板型に変化させることが可能である.この技術とゴルジ体の形状との間に何らかの関連性がある可能性は考慮に値するだろうか.
ゴルジ体,厳密にいうとゴルジスタックは,その構造と機能において明確な極性を有している.図1dに示したように,cis-ゴルジ層板は,小胞体で合成されたタンパク質や脂質が初めてゴルジ体に入る部分である.このcis-ゴルジ層板と小胞体の間には,cis-ゴルジネットワーク(CGN)または小胞体-ゴルジ中間コンパートメント(ERGIC)と呼ばれる複雑な網目状の構造体が存在する.一方で,trans-ゴルジ層板は,trans-ゴルジネットワーク(TGN)とともに,ゴルジ体を通過する物質が選別され放出される場所とされている.medial-ゴルジ層板は,cis-とtrans-ゴルジ層板の間に位置している.
cis-ゴルジ,medial-ゴルジ,trans-ゴルジの各層板は,空間的な配置だけでなく,生化学的な特性も異なっている.たとえば,これらの層板には,タンパク質や脂質の化学修飾を触媒する多様な酵素が層板特異的に局在している.これらの酵素には,糖鎖の付加や除去(グリコシル化,脱グリコシル化),硫酸基の付加(硫酸化),リン酸基の付加(リン酸化)に関わる酵素などが含まれる.これらの酵素の特異的な発現と局在によって,独自の化学修飾が施され,一連の翻訳後修飾を持つタンパク質や脂質が生成される.
なお,これらの化学修飾酵素がゴルジ体の特定の層板に局在するための明確なシグナル配列はまだ同定されていない.かつて提唱された“kin recognition”というモデルでは,これらの酵素が酵素ドメインを介してヘテロ多量体を形成しそれが化学修飾の効率化と局在化に寄与するとされている11).しかし,cis-ゴルジやmedial-ゴルジのマーカーとして我々が使用するManII-GFPは,ゴルジアルファマンノシダーゼIIの酵素ドメインをGFPで置き換えたものであり12),この事実から酵素ドメイン以外の配列が局在化に重要であることが理解できる.
なお,37アミノ酸残基から成る特定のモチーフを用いてcis-ゴルジのマーカーでありゴルジマトリックスタンパク質として同定されたGM13013)と部分的に共局在する領域へのターゲティングが可能であるとされている14).また,いくつかのゴルジ体のタンパク質の一部はゴルジ標的化シグナルとして利用可能であることが報告されている15, 16).
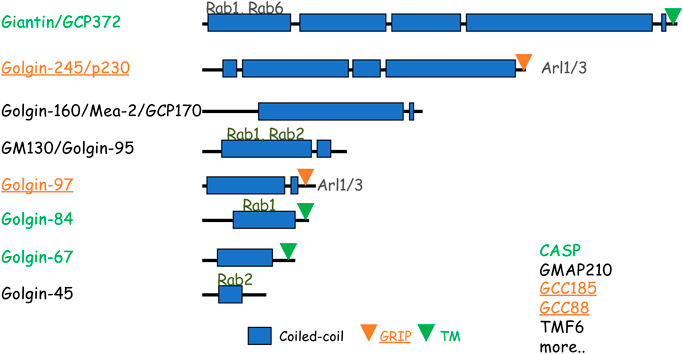
ゴルジ体に局在しコイルドコイルを持つタンパク質群はゴルジンと呼ばれ,図2に示した複数のタンパク質が含まれる.コイルドコイルは,左巻きのヘリックス構造とヘプタッド繰り返しパターン(七つのアミノ酸からなるペプチドをabcdefgで表した場合,位置aとdは主に疎水性のアミノ酸で占められ,eとgは親水性のアミノ酸が多くみられる,この繰り返し)からなり,真核生物,細菌,古細菌など,生物界全体のタンパク質に一般的にみられる.COILSアルゴリズムによると,真核生物の全ゲノムがコードするタンパク質の約10%がこの構造を持つとされている17).この構造は,一般に異なる分子や構造体を接続する役割や細胞の構造維持に寄与すると考えられている17).
ゴルジンにはそのC末端にゴルジ体膜貫通部位またはゴルジ体膜へのアンカー部位があり,これらを介してゴルジ体に固定される18).一方,N末端を含む細胞質側の長いコイルドコイルが,触手のように伸びてさまざまな分子や構造体をゴルジ体につなぎ止める役割を果たしている19).このつなぎ止めの過程には,ゴルジン以外にも,conserved oligomeric Golgi(COG)複合体20),Golgi-associated retrograde protein(GARP)複合体21),Ras-related in brain(Rabs)などの低分子量GTP加水分解酵素群,およびSNAREs[soluble NSF(N-ethylmaleimide-sensitive fusion protein)attachment protein receptor]が関与しているが,ここでは省略する.
ゴルジンは長さ50~400 nmの棒状のタンパク質で,ゴルジスタック(パンケーキ状の膜構造)の直径がおよそ500~1000 nmであると考えればそのつなぎ止めのスケールがわかるだろう.C末端の貫通部位またはアンカー部位を介してゴルジンはゴルジ体内の異なる層板・場所に局在する22).細胞質側のコイルドコイル以外の部分は多様な構造と配列を持ち,各ゴルジンそれぞれ独自の機能に寄与している.このようなゴルジンの特性は,ゴルジ体の構造とアイデンティティ(他のオルガネラとの区別)の両方の維持に一定の貢献をしているようである.以下,ゴルジ体の構造とアイデンティティを書き分けずゴルジ体の構造とのみ記す.
たとえば,GRASPs欠損細胞ではゴルジスタック構造が不全になるが,ゴルジンとして知られるGM130やGolgin-45を過剰に発現させるとスタック状のゴルジ体が復活する23).また,Golgin-84を過剰に発現させるとゴルジ体を破壊する薬物であるブレフェルジンAに対する耐性がみられ,ゴルジ体が強化されたようにみえる24).さらに,Giantinが発現せずリボン状のゴルジ体を持たないDrosophila melanogasterの細胞にGiantinを発現させるとゴルジスタックがリボンのように集積する25).一方で,Giantinを遺伝子ノックダウンすると一部の細胞ではゴルジスタックが横方向に連結しゴルジリボンが長くなる12).例は多く一つ一つ詳細に述べることはできないが,これらの事例はゴルジンがゴルジ体の構造の維持に貢献していることを示唆している.
特に注目すべきは,生理的な条件下で,GM130が単独またはRNAとともに液滴を形成する能力があることである.この液滴形成が,ゴルジ体やゴルジリボンの礎になっている可能性が示唆されている26, 27).ゴルジ体の構造維持以外の機能としてゴルジンがアポトーシスや細胞の移動にも関与していることが知られている28, 29).
さらに,バイオインフォマティクスによる最近の解析がゴルジ体の構造とゴルジンとの関係について新しい知見を提供している30).その解析によると,嫌気性の真核細胞であるMastigamoeba balamuthiにおそらく非積層型のゴルジ体が存在することが示された.さらに,98種の生物のゲノムを解析した結果,約15億年前に存在した真核生物の共通の祖先(last eukaryotic common ancestor:LECA)には,ゴルジ体の構造に関与する少なくとも10種類のタンパク質が存在していたであろうことが示唆された.これらのタンパク質は,進化の過程で機能的なドメインを獲得し多様性を増してきたと考えられる.そして,このような進化的背景により,現在の真核生物ではさまざまなゴルジンが組み合わさって,LECAの時代よりもはるかに複雑で組織化されたゴルジ体構造を形成することができるようになったと考えられる.
この論文によると,ゴルジンの一つであるGM130は動物界およびそれに近縁の単細胞生物群であるHolozoaで初めて確認された.一方,膜型のゴルジンの一部であるGolgin-97, Golgin-84, CDP/cut alternatively spliced product(CASP),Golgi microtubule-associated protein 210(GMAP210),TATA element modulatory factor(TMF)はLECAにも存在していたと推測されている30).さらに,Rabsや同じく低分子量GTP加水分解酵素群であるADP-ribosylation factors(Arfs)に相当するタンパク質は,LECA以前から存在していた可能性が示されている31).このような研究は,ゴルジ体とゴルジンの進化的な関係性と複雑性についてより深い理解を助けるものと考えられる.
ゴルジリボンについて,二つの主要な領域,すなわちコンパクトなゴルジスタック部分と,それから伸びる管状構造のノンコンパクト領域から成るモデルが支持されている32).ゴルジスタックとノンコンパクト領域は,管状構造や小胞の融合,繋留によって結びつき,ゴルジスタックをリボン状につなげるとされている.最近の研究によるとこのノンコンパクト領域は,中間コンパートメントやリサイクリングエンドソームなどと性質が近く,独立したオルガネラとして機能する可能性があるとされている33).今後,マーカーを用いた微細構造の解析や画像分類技術によってこの領域の特性がさらに明らかにされるだろう.
ゴルジ体が,リボン構造をとることの生物学的意義の大部分はまだ明らかにされていない.しかし,細胞運動や遊走,細胞分裂の際など細胞の動きが伴う状況においては,ゴルジ体が細胞質に分散しているよりも一つの塊として存在する方がより効率的かつ安定的な制御が可能であると考えられる.同様に,シグナル伝達のプラットフォームとしても1か所に集約されている方が制御に有利である可能性がある.
その他にも,ゴルジ体が細胞内で生成する巨大分子を効率良く輸送するために特定の構造を有することも考えられる.たとえばIgGのように15 nm程度の大きさ34)のタンパク質は,ゴルジ体や小胞体周辺での輸送を担う約100 nmの小胞であるcoat protein complex I(COPI)やCOPII小胞によって輸送される35, 36).
しかし,これらの輸送小胞のサイズを大きく超える,たとえば魚のうろこ,哺乳類の表皮(コラーゲン)や血管内皮細胞に特有の巨大分泌顆粒Weibel-Palade bodies(WPB)などの巨大な分子や構造体の輸送はどうなるのだろうか.コラーゲンの輸送異常が軟骨形成に問題を引き起こす例があり,この問題の一因として小胞体からの輸送を担うCOPII小胞の構成要素であるSec23やSec24の変異が指摘されている37, 38).これは,Sec23やSec24がCOPII小胞だけでなくコラーゲンのような巨大分子を輸送する特別な構造体にも関与することを示している39).
ゴルジ体においても,ゴルジンの一つであるGiantinをノックダウンまたはノックアウトするとゴルジリボンの組織化が乱れ25),軟骨や細胞外マトリックスの形成に異常が出ることが報告されている40, 41).このような研究から,少なくとも使用されたモデル生物では,Giantinを含む正常なゴルジ体が巨大分子,特にコラーゲンの輸送・分泌に必須であると考えられる.
さらに,ゴルジ体のリボン構造が巨大分子の輸送において重要な役割を果たしている可能性を示唆する研究——WPBとゴルジ体の大きさに関する研究が行われ,その結果が数理モデルとシミュレーションとともに報告されている42, 43).WPBは,血管損傷における血液凝固や炎症反応の開始に関わる糖タンパク質であるvon Willebrand因子(vWF)を含む構造体である.このvWFはゴルジ体内で500~1000 nmの大きさに構造化される.このようにして形成されたvWF構造体は,trans-ゴルジ層板でWPBに取り込まれる.最終的なWPBの大きさはゴルジリボンの大きさに依存することが示された42).
より具体的には,通常のゴルジリボンが存在する場合,WPBは数µmの大きさだが,ミニゴルジスタックが存在する状況では,WPBも500~1000 nmと,ミニゴルジスタックと同程度の大きさになる.興味深いことに,このミニゴルジスタック由来の小さいWPBは,血液凝固において血小板のリクルート能力が低下する一方で,炎症反応には影響を及ぼさなかった.これは,ゴルジ体の構造がWPBの大きさ,そしてその機能にも一定の影響を与える可能性があるということを示唆する42).
さらに,WPBとゴルジリボンに関する数理モデルの研究から,哺乳類細胞のゴルジリボン内で安定したミニゴルジスタックの二量体が存在する可能性が予測されている43).この予測は,Giantinのノックダウン実験によって示されたゴルジリボン内の構造が一定の組織性を持つことによってさらなる支持を得ている25).このような一連の研究成果は,ゴルジ体の構造とWPBの生物学的な機能との密接な関連性を示している.
PubMedのデータベースで「Golgi」をキーワードに検索すると,約54,000件の論文がヒットする(2023年7月時点).著者自身がゴルジ体に関する研究を始めた当初には,ヒット数が30,000件に満たなかったと記憶している.この増加は,間違いなくこの分野での盛んな研究活動を反映していると言えるだろう.しかし,ゴルジリボンやゴルジスタックの生物学的な意義,さらにはゴルジスタックのcis-trans極性の維持やゴルジ体の形成と継承といったテーマについては,未解明の課題が多く残されていると感じている.これらの問題に対する今後の研究が一層進展することを,心より期待している.
引用文献References
1) Bentivoglio, M. (1998) 1898: The Golgi apparatus emerges from nerve cells. Trends Neurosci., 21, 195–200.
2) Dröscher, A. (1998) The history of the Golgi apparatus in neurones from its discovery in 1898 to electron microscopy. Brain Res. Bull., 47, 199–203.
3) Gosavi, P. & Gleeson, P.A. (2017) The function of the Golgi Ribbon Structure—An enduring mystery unfolds! BioEssays News Rev. Mol. Cell Dev. Biol., 39, 1700063.
4) Wang, Y. & Seemann, J. (2011) Golgi biogenesis. Cold Spring Harb. Perspect. Biol., 3, a005330.
5) Ayala, I. & Colanzi, A. (2022) Structural organization and function of the Golgi Ribbon during cell division. Front. Cell Dev. Biol., 10, 925228.
6) Ahat, E., Li, J., & Wang, Y. (2019) New insights into the Golgi stacking proteins. Front. Cell Dev. Biol., 7, 131.
7) Xiang, Y. & Wang, Y. (2010) GRASP55 and GRASP65 play complementary and essential roles in Golgi cisternal stacking. J. Cell Biol., 188, 237–251.
8) Zhang, Y. & Seemann, J. (2021) Rapid degradation of GRASP55 and GRASP65 reveals their immediate impact on the Golgi structure. J. Cell Biol., 220, e202007052.
9) Levi, S.K., Bhattacharyya, D., Strack, R.L., Austin, J.R. II, & Glick, B.S. (2010) The yeast GRASP Grh1 colocalizes with COPII and is dispensable for organizing the secretory pathway. Traffic Cph. Den., 11, 1168–1179.
10) Fontana, N.A., Fonseca-Maldonado, R., Mendes, L.F.S., Meleiro, L.P., & Costa-Filho, A.J. (2018) The yeast GRASP Grh1 displays a high polypeptide backbone mobility along with an amyloidogenic behavior. Sci. Rep., 8, 15690.
11) Nilsson, T., Slusarewicz, P., Hoe, M.H., & Warren, G. (1993) Kin recognition. A model for the retention of Golgi enzymes. FEBS Lett., 330, 1–4.
12) Satoh, A., Hayashi-Nishino, M., Shakuno, T., Masuda, J., Koreishi, M., Murakami, R., Nakamura, Y., Nakamura, T., Abe-Kanoh, N., Honjo, Y., et al. (2019) The Golgin protein giantin regulates interconnections between Golgi stacks. Front. Cell Dev. Biol., 7, 160.
13) Nakamura, N., Rabouille, C., Watson, R., Nilsson, T., Hui, N., Slusarewicz, P., Kreis, T.E., & Warren, G. (1995) Characterization of a cis-Golgi matrix protein, GM130. J. Cell Biol., 131, 1715–1726.
14) Navarro, A.P. & Cheeseman, I.M. (2022) Identification of a Golgi-localized peptide reveals a minimal Golgi-targeting motif. Mol. Biol. Cell, 33, ar110.
15) Engelke, M.F., Winding, M., Yue, Y., Shastry, S., Teloni, F., Reddy, S., Blasius, T.L., Soppina, P., Hancock, W.O., Gelfand, V.I., et al. (2016) Engineered kinesin motor proteins amenable to small-molecule inhibition. Nat. Commun., 7, 11159.
16) Onuma, H., Komatsu, T., Arita, M., Hanaoka, K., Ueno, T., Terai, T., Nagano, T., & Inoue, T. (2014) Rapidly rendering cells phagocytic through a cell surface display technique and concurrent Rac activation. Sci. Signal., 7, rs4.
17) Rose, A., Schraegle, S.J., Stahlberg, E.A., & Meier, I. (2005) Coiled-coil protein composition of 22 proteomes—Differences and common themes in subcellular infrastructure and traffic control. BMC Evol. Biol., 5, 66.
18) Witkos, T.M. & Lowe, M. (2015) The Golgin family of coiled-coil tethering proteins. Front. Cell Dev. Biol., 3, 86.
19) Wong, M., Gillingham, A.K., & Munro, S. (2017) The golgin coiled-coil proteins capture different types of transport carriers via distinct N-terminal motifs. BMC Biol., 15, 3.
20) Blackburn, J.B., D’Souza, Z., & Lupashin, V.V. (2019) Maintaining order: COG complex controls Golgi trafficking, processing, and sorting. FEBS Lett., 593, 2466–2487.
21) Khakurel, A., Kudlyk, T., Bonifacino, J.S., & Lupashin, V.V. (2021) The Golgi-associated retrograde protein (GARP) complex plays an essential role in the maintenance of the Golgi glycosylation machinery. Mol. Biol. Cell, 32, 1594–1610.
22) Malsam, J., Satoh, A., Pelletier, L., & Warren, G. (2005) Golgin tethers define subpopulations of COPI vesicles. Science, 307, 1095–1098.
23) Lee, I., Tiwari, N., Dunlop, M.H., Graham, M., Liu, X., & Rothman, J.E. (2014) Membrane adhesion dictates Golgi stacking and cisternal morphology. Proc. Natl. Acad. Sci. USA, 111, 1849–1854.
24) Satoh, A., Wang, Y., Malsam, J., Beard, M.B., & Warren, G. (2003) Golgin-84 is a rab1 binding partner involved in Golgi structure. Traffic Cph. Den., 4, 153–161.
25) Koreishi, M., Gniadek, T.J., Yu, S., Masuda, J., Honjo, Y., & Satoh, A. (2013) The golgin tether giantin regulates the secretory pathway by controlling stack organization within Golgi apparatus. PLoS One, 8, e59821.
26) Rebane, A.A., Ziltener, P., LaMonica, L.C., Bauer, A.H., Zheng, H., López-Montero, I., Pincet, F., Rothman, J.E., & Ernst, A.M. (2020) Liquid–liquid phase separation of the Golgi matrix protein GM130. FEBS Lett., 594, 1132–1144.
27) Zhang Y, Seemann J. (2023) RNA scaffolds the Golgi ribbon by forming condensates with GM130. bioRxiv, 2023.03.02.530905.
28) He, Q., Liu, H., Deng, S., Chen, X., Li, D., Jiang, X., Zeng, W., & Lu, W. (2020) The Golgi apparatus may be a potential therapeutic target for apoptosis-related neurological diseases. Front. Cell Dev. Biol., 8, 830.
29) Tang, C.X., Luan, L., Zhang, L., Wang, Y., Liu, X.F., Wang, J., Xiong, Y., Wang, D., Huang, L.Y., & Gao, D.S. (2019) Golgin-160 and GMAP210 play an important role in U251 cells migration and invasion initiated by GDNF. PLoS One, 14, e0211501.
30) Barlow, L.D., Nývltová, E., Aguilar, M., Tachezy, J., & Dacks, J.B. (2018) A sophisticated, differentiated Golgi in the ancestor of eukaryotes. BMC Biol., 16, 27.
31) Klinger, C.M., Spang, A., Dacks, J.B., & Ettema, T.J.G. (2016) Tracing the archaeal origins of eukaryotic membrane-trafficking system building blocks. Mol. Biol. Evol., 33, 1528–1541.
32) Mironov, A.A. & Beznoussenko, G.V. (2011) Molecular mechanisms responsible for formation of Golgi ribbon. Histol. Histopathol., 26, 117–133.
33) Saraste, J. & Prydz, K. (2019) A new look at the functional organization of the Golgi ribbon. Front. Cell Dev. Biol., 7, 171.
34) Tan, Y.H., Liu, M., Nolting, B., Go, J.G., Gervay-Hague, J., & Liu, G.Y. (2008) A nanoengineering approach for investigation and regulation of protein immobilization. ACS Nano, 2, 2374–2384.
35) Rutz, C., Satoh, A., Ronchi, P., Brügger, B., Warren, G., & Wieland, F.T. (2009) Following the fate in vivo of COPI vesicles generated in vitro. Traffic, 10, 994–1005.
36) Stagg, S.M., LaPointe, P., Razvi, A., Gürkan, C., Potter, C.S., Carragher, B., & Balch, W.E. (2008) Structural basis for cargo regulation of COPII coat assembly. Cell, 134, 474–484.
37) Boyadjiev, S.A., Fromme, J.C., Ben, J., Chong, S.S., Nauta, C., Hur, D.J., Zhang, G., Hamamoto, S., Schekman, R., Ravazzola, M., et al. (2006) Cranio-lenticulo-sutural dysplasia is caused by a SEC23A mutation leading to abnormal endoplasmic-reticulum-to-Golgi trafficking. Nat. Genet., 38, 1192–1197.
38) Garbes, L., Kim, K., Rieß, A., Hoyer-Kuhn, H., Beleggia, F., Bevot, A., Kim, M.J., Huh, Y.H., Kweon, H.S., Savarirayan, R., et al. (2015) Mutations in SEC24D, encoding a component of the COPII machinery, cause a syndromic form of osteogenesis imperfecta. Am. J. Hum. Genet., 96, 432–439.
39) Raote, I., Saxena, S., & Malhotra, V. (2023) Sorting and export of proteins at the endoplasmic reticulum. Cold Spring Harb. Perspect. Biol., 15, a041258.
40) Katayama, K., Kuriki, M., Kamiya, T., Tochigi, Y., & Suzuki, H. (2018) Giantin is required for coordinated production of aggrecan, link protein and type XI collagen during chondrogenesis. Biochem. Biophys. Res. Commun., 499, 459–465.
41) Stevenson, N.L., Bergen, D.J.M., Lu, Y., Prada-Sanchez, M.E., Kadler, K.E., Hammond, C.L., & Stephens, D.J. (2021) Giantin is required for intracellular N-terminal processing of type I procollagen. J. Cell Biol., 220, e202005166.
42) Ferraro, F., Kriston-Vizi, J., Metcalf, D.J., Martin-Martin, B., Freeman, J., Burden, J.J., Westmoreland, D., Dyer, C.E., Knight, A.E., Ketteler, R., et al. (2014) A two-tier Golgi-based control of organelle size underpins the functional plasticity of endothelial cells. Dev. Cell, 29, 292–304.
43) Page, K.M., McCormack, J.J., Lopes-da-Silva, M., Patella, F., Harrison-Lavoie, K., Burden, J.J., Quah, Y.B., Scaglioni, D., Ferraro, F., & Cutler, D.F. (2022) Structure modeling hints at a granular organization of the Golgi ribbon. BMC Biol., 20, 111.