植物および真核微生物の細胞内には一重膜細胞小器官(オルガネラ)である液胞が発達する.また,動物細胞には液胞に相当するリソソームが存在する.両者の共通点は生体高分子の分解を担う点であり,その内腔は液胞/リソソーム膜に局在するV-ATPaseによって酸性に維持され,酸性側に至適pHを持つ多種多様な分解酵素が働いている.液胞とリソソームの相違点はその大きさであり,植物液胞が40 µm径程度,また出芽酵母の液胞が約3 µm径であるのに対し,動物リソソームはわずか0.05~0.5 µm径である.その大きさを反映し,液胞は栄養や多様な二次代謝産物を貯蔵し,毒物が侵入すればこれを隔離・解毒する.また水分や塩分の出し入れにより浸透圧調節を行う他,植物では膨圧によって個体を支える役割も担っている.こうした液胞/リソソームの機能発現には液胞/リソソーム膜を介した内外への物質輸送が不可欠である.そこには多様なトランスポータータンパク質が機能しているはずである.
細胞内のアミノ酸濃度はタンパク質合成の律速段階となっており,TORC1などの栄養シグナル伝達系により適正に維持され,細胞の生育速度を決定づけている.細胞内のアミノ酸ホメオスタシスは,アミノ酸の合成や分解,細胞内への取り込み,タンパク質の合成や分解といった多様な代謝プロセスが統合的に調節されることにより達成される.これまで,これら各プロセスの機構解明がアミノ酸ホメオスタシスの全体像理解に大きく貢献してきた.しかし,細胞内アミノ酸分布の重要性については依然十分な検討は行われていない.液胞/リソソームではオートファジー等のタンパク質分解によって多量のアミノ酸が生成される.また植物や真核微生物の液胞はアミノ酸貯蔵プールとして古くから知られている.
近年,オートファジー研究の進展により,液胞/リソソームからサイトゾルへのアミノ酸リサイクルが細胞分化および飢餓条件での生存等に果たす役割がクロースアップされている.しかし,オートファジーではタンパク質だけでなく多様なオルガネラも分解されることから,リサイクルされるのはアミノ酸だけではなく,核酸,金属,脂質,糖など多岐にわたると考えられる1).さらに,オートファジーは損傷したオルガネラやタンパク質を除去する細胞内浄化作用も担う.したがって,液胞/リソソームからのアミノ酸リサイクルの生理的意義を正しく理解するには,オートファジー欠損株の解析ではなく,サイトゾルへのアミノ酸排出のみを特異的に遮断し,その影響を評価する必要がある.その一方で,栄養豊富条件で液胞内に蓄積したアミノ酸は,栄養の備蓄と捉えられてきたが,その実験的な検証では,液胞内へのアミノ酸取り込みを特異的に遮断し,飢餓条件等での生育・生存への影響を検討することになる.いずれも,液胞/リソソーム内外へアミノ酸を輸送するトランスポーターを欠損させることになるが,これらトランスポーターの同定が動物および出芽酵母において,近年徐々に進められている.加えて,動物リソソームアミノ酸トランスポーターには細胞内の栄養状態を感知する受容体機能も提唱されている.この受容体機能の詳細については原著論文・関連総説を参照いただきたい.本稿では現時点で明らかとなっている液胞/リソソームアミノ酸トランスポーターの概要を示した上でその調節,生理的役割を解説し,現状の課題と将来の展望を述べる.
シナプス小胞膜にはリソソーム膜と同じくV-ATPaseが存在し,小胞内外でのプロトン濃度勾配はGABAやグルタミン酸といった神経伝達物質の集積に利用される.SLC32ファミリーに属するVGATはシナプス小胞にGABAおよびGlyを取り込むトランスポーターとして報告された2, 3).SLC32ファミリーはSLC36ファミリーおよびSLC38ファミリーと同じくAAAP(amino acid/auxin permease)superfamilyにまとめられている.SLC36ファミリーのLYAAT-1/PAT1はリソソーム膜に局在し,プロトン濃度勾配に依存してPro, Ala, Glyといった中性アミノ酸をリソソーム外へと排出する4).また,近年,SLC38A9がリソソーム膜に局在しGln, Arg, Leuを輸送することが報告された5, 6).リポソームへと再構成したSLC38A9のGln輸送のVmaxは低く(8.8±0.57 nmol/mg prot/min),Kmも518±58 µmolと高い7).さらに,Argに対する親和性も比較的低い(Km=2.7±0.83 mM).Argが結合した立体構造が報告されているが8),細胞内ではアミノ酸輸送よりむしろ,後述のようにリソソーム内のアミノ酸を感知しmTORC1と直接相互作用して活性化する受容体機能も兼ねたトランスセプターであることが示唆されている7).
シスチノーシスはシスチンをリソソーム外へと排出するシスチノシンの変異によりシスチンが異常蓄積し,リソソーム機能が障害されることによって発症するリソソーム病の一種である.最近報告されたシスチノシンの立体構造は7回膜貫通型であり,プロトンとの共輸送によるシスチンの排出機構,およびmTORC1との相互作用に関わる領域も示された9, 10).シスチノシンが属するLCT(lysosomal cystine transporter)ファミリーにはリソソーム膜に局在するPQLC2(SLC66A1)も含まれる.リソソーム膜局在に必要とされるジロイシンモチーフをアラニン置換したPQLC2はカエル卵母細胞に発現させると細胞膜に局在し,細胞外pHが5.0の条件下で細胞の塩基性アミノ酸(Lys, His, Arg)取り込みが増加した一方で,pH 7.0では増加しなかったことから,∆pHに依存して塩基性アミノ酸を輸送することが示唆された11).このPQLC2のArg輸送についてはKmが3.36±0.26 mM, Vmax=112±28 pmol/min/細胞とさほど高い輸送活性ではない.リソソーム内pHが酸性であることを考えるとPQLC2はin vivoで塩基性アミノ酸をリソソームから排出すると考えられる.シスチノーシスの治療ではシステアミンを投与してシステアミン/Cys混合ジスルフィド(MxD)をリソソーム内で生成させ,これをリソソームから排出させることでリソソーム内シスチン濃度を低減させる.このMxDはLysに構造が似ており,その排出にPQLC2が働くことが示された11).
SLC15A4はHisおよびペプチドをリソソーム外へと排出することが報告されている12).TLR7とTLR9はエンドソームとリソソームにおいてそれぞれウイルス・細菌のもつ核酸を認識するToll様受容体であり,I型インターフェロンなどの炎症性サイトカインの産生を促進するが,SLC15A4を欠損するとこれら炎症反応が阻害される.これにはリソソーム内でのHisの異常蓄積によるリソソーム内pH環境の変化およびV-ATPaseとmTORC1活性の変化が関わると考えられている13).シスチノーシスの発症例とも合わせ,リソソームからのアミノ酸排出はリソソーム内環境の適正化にも重要であることがわかる.
1)AVTファミリートランスポーター
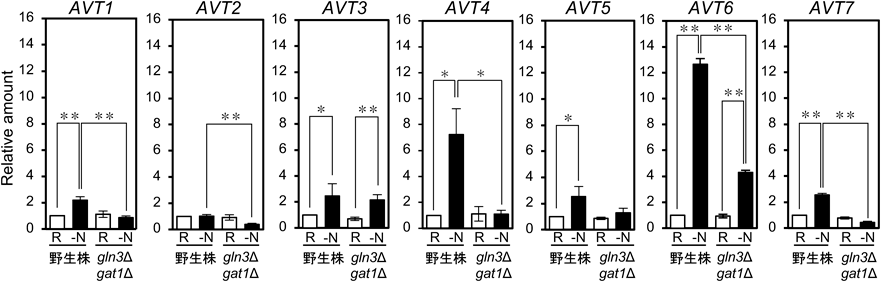
出芽酵母の液胞内アミノ酸プールの研究は古くから行われ,1970年代には塩基性アミノ酸が細胞全体の70~90%と高度に蓄積し,逆に酸性アミノ酸(Glu, Asp)は10%以下とアミノ酸種によって異なる細胞内分布が示されていた.出芽酵母ではこれまで遺伝子の破壊もしくは過剰発現による液胞内アミノ酸含量もしくは単離液胞膜小胞のアミノ酸輸送活性の変化を調べることで液胞アミノ酸トランスポーターが多数同定されている(表1).液胞内アミノ酸は細胞を低濃度の銅イオンで処理し,細胞膜のみを選択的に破壊することによって抽出する14).また,液胞膜小胞はフィコール溶液を用いたフローテーションによって単離した液胞を破砕し超遠心後の沈殿画分として調製する15).VGATを同定したMcIntireのグループは,VGATのホモログであるAvt1~7の7種からなる出芽酵母AAAP(AVTファミリー)の解析も行った16).その結果,野生株とAVT1破壊株より単離した液胞膜小胞への放射標識アミノ酸の取り込みを比較することにより,Avt1がATP依存的にGln, Tyr, Ileを取り込むことが示された.また,AVT3とAVT4を破壊するとGln, Tyr, IleのATP依存的な小胞への取り込みが逆に増加することから,Avt3とAvt4はこれらアミノ酸を液胞外へと排出することが示唆された.さらに液胞膜小胞に前負荷した酸性アミノ酸のATP依存的な排出がAvt6に依存することも見いだした.
表1 酵母液胞アミノ酸トランスポーター| スーパーファミリー | ファミリー | トランスポーター | 輸送基質 | 輸送の向き(in vivo) *1 | 輸送の向き(in vitro) *2 |
|---|
| AAAP | AVT | Avt1 | 中性アミノ酸・His | in*3 | in(V:プロトン濃度勾配) |
| Avt3 | 中性アミノ酸 | out | out(V:プロトン濃度勾配) |
| Avt4 | 中性・塩基性アミノ酸 | out | out(V:プロトン濃度勾配) |
| Avt6 | 酸性アミノ酸 | out | out(V:プロトン濃度勾配) |
| Avt7 | 中性アミノ酸 | out | out (V:プロトン濃度勾配?) |
| TOG | LCT | Ypq1 | Lys・Arg | ND | in (V:プロトン濃度勾配,L:∆pH) |
| Ypq2 | Arg | out | in(V:プロトン濃度勾配,Hisとの交換輸送) |
| out (V:ユニポーター) |
| Ypq3 | His | ND | in(V:プロトン濃度勾配) |
| Ers1 | シスチン | ND | ND*4 |
| SulP | Vsb1 | 塩基性アミノ酸 | in | in(V:プロトン濃度勾配) |
| MFS | VBA | Vba1 | Lys・His | ND | in (V:プロトン濃度勾配?) |
| Vba2 | 塩基性アミノ酸 | ND | in (V:プロトン濃度勾配?) |
| Vba3 | Lys・His | ND | in (V:プロトン濃度勾配?) |
| Atg22 | Tyr・Leu | out | ND |
| APC | Uga4 | GABA | in | ND |
*1液胞内アミノ酸含量から予想される輸送の向き.in:液胞内への取り込み,out:液胞外への排出,ND:未検討.
*2液胞膜小胞(V)もしくはプロテオリポソーム(L)を用いた実験から予想されるin vivoでの輸送の向き.括弧内はアッセイ系と駆動力.in:液胞内への取り込み,out:液胞外への排出,ND:未検討.
*3液胞内ヒスチジン量の変化は未検出.
*4細胞膜に局在化させ,細胞内への取り込みが検出されている. |
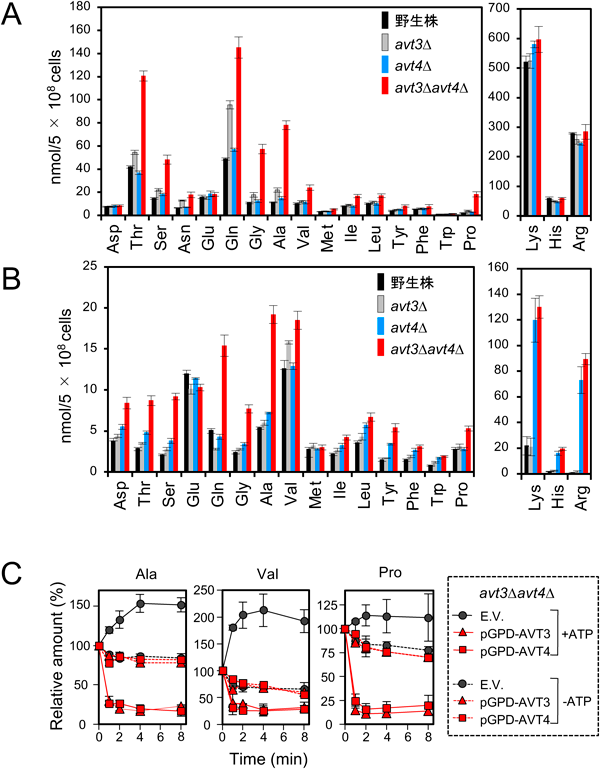
筆者らはこれらAvtトランスポーターのin vivoでの機能を検討するため,破壊株もしくは過剰発現株の液胞内アミノ酸の定量を始めた17).その結果,液胞膜小胞の結果と一致してAvt3とAvt4の二重破壊(avt3∆avt4∆)株では液胞内のGln, Tyr, Ile含量が大幅に増加したのに加え,中性アミノ酸全般の液胞内含量の増加を検出した(図1A).これと一致して,Avt3もしくはAvt4を過剰発現すると,Ala, Val, Proを前負荷した単離液胞膜小胞からの各アミノ酸のATP依存的な排出が検出されたことから(図1C),Avt3とAvt4はin vivoにおいて中性アミノ酸全般を液胞外へ排出することが示唆された.また,オートファジーによって液胞内にアミノ酸が産生する窒素飢餓条件においてもavt3∆avt4∆株では中性アミノ酸全般の液胞内含量は高いまま維持されたことから,オートファジーアミノ酸リサイクルに機能することも示唆された(図1B).さらに,予想外なことに,窒素飢餓条件ではAVT4単一破壊株の液胞内塩基性アミノ酸含量が野生株よりも高いまま維持されていた(図1B).またAVT4を過剰発現すると栄養豊富条件にもかかわらず,液胞内の中性アミノ酸だけでなく塩基性アミノ酸も減少し,単離液胞膜小胞のアルギニン取り込み活性も減少したことから,Avt4は塩基性アミノ酸も液胞外へ排出することが示された17).このように出芽酵母では液胞内アミノ酸の定量を組み合わせることにより,液胞アミノ酸トランスポーターの新規輸送基質が明らかとなっている.それまではArg, Lys, His, Phe, Trp, Gln, Asn, Tyr, Leu, Ileの10種のアミノ酸が液胞膜小胞内へATP依存的に取り込まれることが示されていたが18),avt3∆avt4∆株由来の液胞膜小胞では排出活性が低下したため,AlaやValをはじめ,その他多くの中性アミノ酸のATP依存的な取り込みが検出された17).このことは液胞膜小胞を介したアミノ酸輸送の向きが取り込みと排出のバランスによって決定されることを示している.筆者らはavt3∆avt4∆株を使って,中性アミノ酸全般の液胞膜小胞へのATP依存的な取り込みがAVT1破壊によって減少することを見いだした19).液胞内の中性アミノ酸含量はAVT1単一破壊ではほとんど変化しなかったが,ここでもavt3∆avt4∆株でAVT1を破壊すると中性アミノ酸全般の液胞内含量が低下したことから,in vitroとin vivoの結果が一致し,AVT1破壊による液胞内への取り込みの減少が,液胞外への排出活性の変化によって相補されることが示唆された19).筆者らは液胞膜小胞へのATP依存的なヒスチジン取り込みがAvt1に依存することも見いだしたが,液胞内のavt3∆avt4∆株でAVT1を破壊してもヒスチジン含量は減少しなかった.このように液胞アミノ酸トランスポーターについては,遺伝子破壊によるin vitroでのアミノ酸輸送活性の変化が液胞内のアミノ酸含量に反映されないケースも多数ある.これは液胞膜小胞単離過程でのトランスポーターの分解および調節因子の分解・解離や,アミノ酸輸送活性測定時のpH等の小胞内外の条件がin vivoと異なるなど複数の要因が考えられ,液胞/リソソームアミノ酸トランスポーターの研究を進める上での課題となっている.
Avt6は酸性アミノ酸を液胞外へと排出することが単離液胞膜小胞を使った実験で示唆されたが16),in vivoでの機能は未検討であった.筆者らは,AVT6破壊株を窒素飢餓条件に移すと液胞内酸性アミノ酸量が野生株より高くなることを見いだした20).このことはAvt6が窒素飢餓条件で酸性アミノ酸の液胞外への排出に機能することを示唆している.一方,Avt7は液胞膜に局在し,avt3∆avt4∆株で欠損すると,GlnとProの液胞内含量が増加することがわかった.液胞膜小胞のATP依存的なGln・Pro取り込みもAVT7の過剰発現により減少したことから,Avt7はこれらアミノ酸を液胞外へ排出する新規液胞アミノ酸トランスポーターであることが示唆された21).AVTファミリーにはAvt2とAvt5も含まれるが,これらの液胞アミノ酸輸送への関与は未知である.
2)LCTファミリートランスポーター
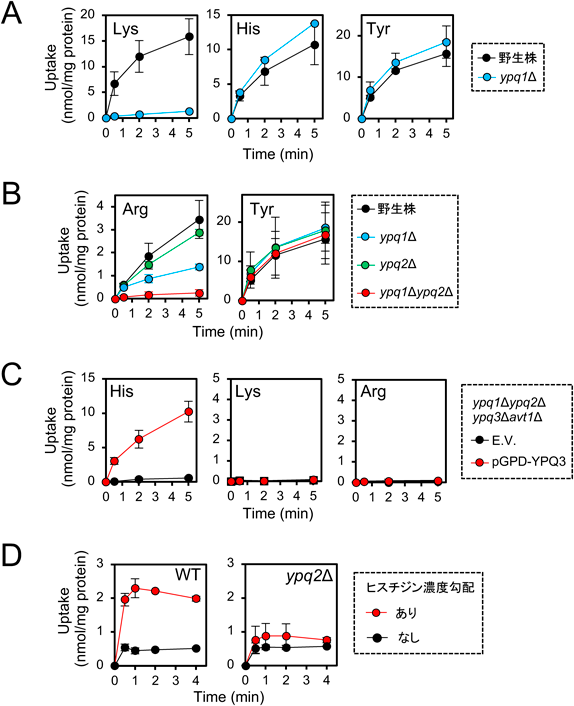
LCTファミリーは出芽酵母ではYpq1, Ypq2, Ypq3, Ers1, Any1, Ilt1の6種がコードされている.このうちシスチノシンホモログであるErs1は液胞膜に局在するが,過剰発現すると細胞膜にも局在し,シスチンを細胞内に取り込む22).またERS1破壊株はハイグロマイシンBに感受性となるがシスチノシンの異種発現によって相補されることから,Ers1はシスチノシンホモログとして酵母液胞においてシスチンの輸送に機能することが示唆された22).一方,Ypq2は欠損によりArgの毒性アナログであるカナバニンに耐性となり,窒素飢餓条件での液胞内Arg含量が野生株より高いまま維持されることから,in vivoではArgを液胞外へ排出することが示唆されている11, 23).これと一致して,液胞膜小胞に前負荷された放射標識ArgがATP非存在下においてもYpq2依存的に小胞外へと排出されたことから,Ypq2はユニポーターであることが示唆された23).しかし,筆者らはYpq1, Ypq2, Ypq3が単離液胞膜小胞へのATP依存的なLys/Arg, Arg, Hisの取り込みにそれぞれ関与することを見いだし(図2A–C)24–26),さらにYpq2は以前報告された液胞膜小胞のHis/Arg交換輸送活性の本体であることも報告した(図2D)26, 27).液胞膜小胞には多くのトランスポーターが存在するため,こうした多様な輸送活性の中には間接的に他のトランスポーターの輸送活性を反映したものが含まれている可能性がある.よって,トランスポーターとしての活性を正確に理解するためには,リポソーム再構成系やカエル卵母細胞を用いた解析が必要である.最近,Ypq1のリポソームへの再構成が報告され,∆pH(pHin<pHout)依存的にリポソーム内に塩基性アミノ酸を取り込むことが示された28).この結果は筆者らの液胞膜小胞を用いた結果と一致している.こうした精製トランスポーターの再構成系で検出される活性とin vivoでの液胞内含量への影響の間での整合性の検討が待たれる.他のLCTファミリーメンバーであるAny1はエンドソーム/TGNに局在しリン脂質のフリッパーゼおよびスクランブラーゼとして機能することが示唆され29, 30),Ilt1は細胞膜に局在し,薬剤耐性への関与が報告されているが現段階では機能未知である.
3)Vsb1
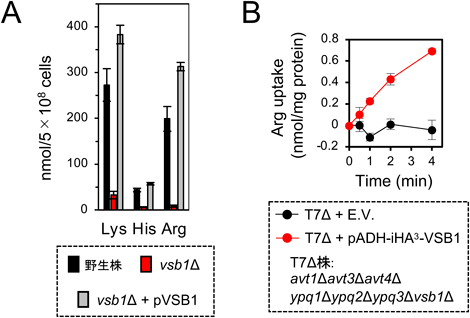
前述のようにYpqタンパク質に依存した塩基性アミノ酸のATP依存的な液胞膜小胞への取り込みが検出されたが,Ypq1~3すべてを欠損しても液胞内に塩基性アミノ酸が依然蓄積することから,in vivoでは塩基性アミノ酸取り込みを担う主要なトランスポーターが別に存在することが示唆されていた.近年,この塩基性アミノ酸蓄積に関わる主要因子としてVsb1が同定された.Vsb1はSulPトランスポーターファミリーに属し,欠損すると液胞内の塩基性アミノ酸量が大幅に減少する(図3A)23, 31).筆者らはさらにAVTとYPQの多重破壊株にVSB1を過剰発現させ,単離した液胞膜小胞のATP依存的なArg取り込み活性の増加を検出した(図3B)31).また,推定膜貫通領域内の保存Asp残基(D223)をAlaに置換した変異型Vsb1はvsb1∆株に発現させると,液胞膜に局在するにもかかわらず,塩基性アミノ酸を蓄積しないことから,Vsb1はin vivoで塩基性アミノ酸トランスポーターとして機能することが示唆された31).しかし,輸送活性の検討は液胞膜小胞を使った実験にとどまっており,Vsb1が他のトランスポーターに間接的に作用する可能性は否定できない.
4)その他の液胞アミノ酸トランスポーター
出芽酵母のmajor facilitator superfamily(MFS)に属するVba1, Vba2, Vba3は液胞膜小胞に塩基アミノ酸を取り込むことが示されたが32),前述のように,液胞内への塩基性アミノ酸蓄積はVsb1欠損によってほぼ失われることからin vivoでは塩基性アミノ酸取り込みには機能しない可能性が高い.また,薬剤耐性にも関与することからin vivoでの輸送基質はアミノ酸以外の物質であることも示唆されている.同じくMFSに属するAtg22は欠損による液胞内の分岐鎖アミノ酸やTyrの含量増加が報告されている33).興味深いことに,Atg22欠損株では窒素飢餓条件で液胞内プロテアーゼの合成が低下し,液胞内でのオートファジックボディの分解が抑制されることも示されている33, 34).
多数の細胞膜アミノ酸トランスポーターを含むamino-acid-polyamine-organocation(APC)superfamilyの中でUga4は液胞膜に局在することが示されている.Uga4は過剰発現によって増加した細胞内のGABA含量がV-ATPase特異的な阻害剤バフィロマイシンA1処理により抑制されることから,GABAを液胞内へ輸送することが示唆されている35).Atg22とUga4はいずれもアミノ酸の輸送活性について液胞膜小胞およびプロテオリポソームを用いた直接的な検討は行われていない.トランスポーターとしての機能については今後さらなる検討が必要である.
4. 他の真核微生物および植物の液胞アミノ酸トランスポーター
出芽酵母同様,真核細胞のモデル生物として使用される分裂酵母は「酵母」だが,系統的には出芽酵母とはまったく異なることから,分裂酵母の液胞アミノ酸トランスポーターホモログの解析は真核微生物における機能の普遍性を検証することになる.さらに遺伝子数が出芽酵母よりも少ないため,トランスポーター間の機能重複を回避し,遺伝子破壊による表現型検出も期待できる.その一方で,液胞の単離法が確立されておらず,液胞膜を介したアミノ酸輸送活性を検討することができない.これに対して,液胞内外のプロトン濃度勾配を形成するV-ATPaseの特異的阻害剤(コンカナマイシンAやバフィロマイシンA1)で処理すると,細胞のアミノ酸取り込みが低下することから,液胞膜を介したアミノ酸輸送の変化が細胞へのアミノ酸取り込みに反映されるとして,当初研究が進められた.分裂酵母のAVTトランスポーターは2種のみ(SpAvt3とSpAvt5)と出芽酵母に比べ大幅に少ない.出芽酵母のAvt6と高い相同性を有する分裂酵母ホモログSpAvt5は液胞膜に局在し,欠損すると塩基性アミノ酸,Tyr, Gluの細胞内への取り込みが減少したことから,これらアミノ酸の液胞内取り込みへの関与が示唆された36).一方,VBAホモログは3種コードされ,いずれも液胞膜に局在し,同様の解析によりFnx1とFnx2がLys, Ile, Asn, SpVba2が塩基性アミノ酸全般をそれぞれ液胞内に取り込むことが示唆された37, 38).しかし,これら分裂酵母ホモログのin vivoでの機能について,さらなる検討が必要である.SpVba2については出芽酵母に発現させると液胞膜に局在し,液胞膜小胞のLysとArgの取り込みと液胞内のこれらアミノ酸含量の増加も示された39).その一方でキニジンなど薬剤耐性への関与も示唆されている39).SpAvt3も出芽酵母で発現させ,液胞膜小胞を用いて中性・塩基性アミノ酸の排出活性が検出された40).またYpqタンパク質ホモログであるStm1を発現した出芽酵母から単離した液胞膜小胞ではArg/ArgおよびHis/Arg交換輸送活性とプロトン濃度勾配に依存したArgおよびLysの取り込み活性が検出された41).その一方で分裂酵母stm1破壊株は液胞内LysとHisが野生株に比べて減少し,Argは逆に増加した41).複数の輸送様式がin vitroで検出される点と,液胞膜小胞で検出される基質輸送の方向がin vivoの結果と必ずしも一致しない点は出芽酵母Ypq2と同じであり,こうした矛盾点の解決が課題であると同時に,Ypqタンパク質の機能・性質が真核微生物全般に保存されていることを示唆している.最近,筆者らはVsb1ホモログも分裂酵母液胞の塩基性アミノ酸蓄積に必要であり,保存Asp残基D174がこれに必須であることを報告した42).
植物病原菌であるフザリウム菌,および高等植物であるシロイヌナズナのAvt3ホモログもそのGFP融合タンパク質が液胞膜に局在し,出芽酵母で異種発現させた場合でも液胞膜に局在し,液胞膜小胞のATP依存的な中性・塩基性アミノ酸排出が増加した43, 44).しかし,各生物種での液胞内アミノ酸含量への作用は未検討である.