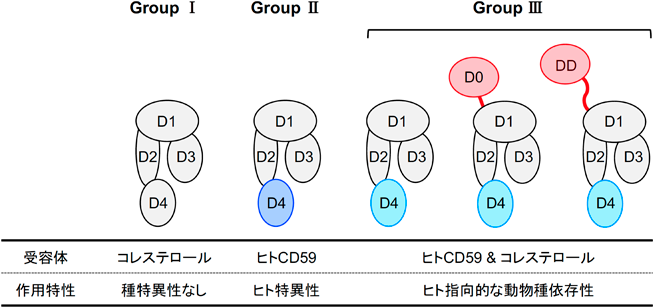
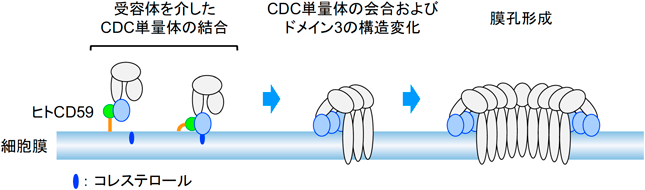
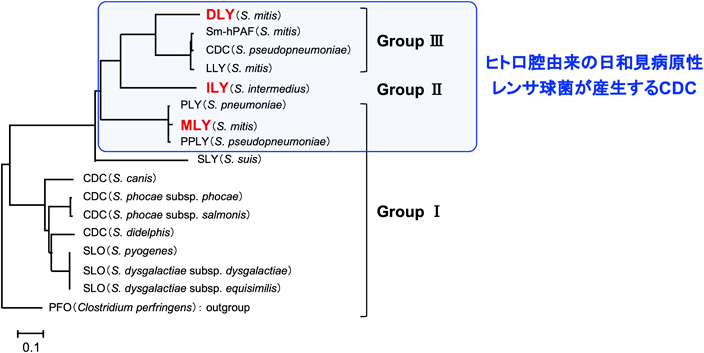
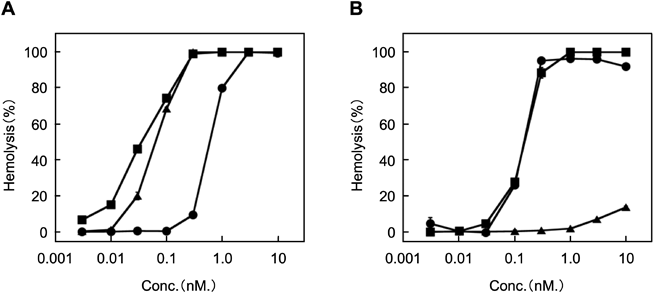
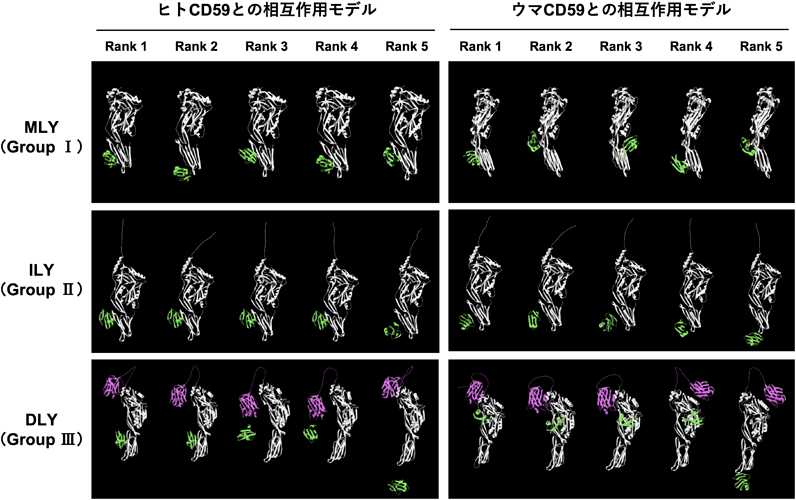
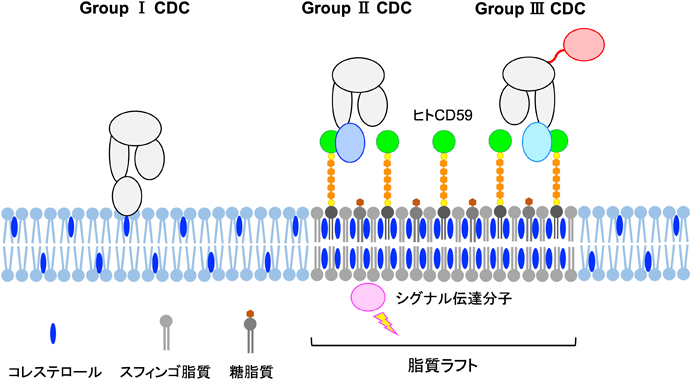
細胞膜に障害を及ぼすレンサ球菌由来溶血毒素の構造的および機能的な多様性The structural- and functional-variety of streptococcal hemolysins inducing the dysfunction of cytoplasmic membrane
徳島大学大学院社会産業理工学研究部生物資源産業学域Department of Bioengineering, Division of Bioscience and Bioindustry, Graduate School of Technology, Industrial and Social Sciences, Tokushima University Graduate School ◇ 〒770–8513 徳島県徳島市南常三島町2丁目1番地 ◇ 2–1 Minamijousanjima-cho, Tokushima, Tokushima 770–8513, Japan