2. PERKによる小胞体でのタンパク質品質管理制御
1)小胞体ストレス応答とは
タンパク質が機能するには正しい立体構造に折りたたまれる必要があり,折りたたみ不全タンパク質が小胞体に蓄積することは細胞にとっては潜在的な脅威で,小胞体ストレスと呼ばれている.小胞体ストレスは,栄養飢餓,低酸素や細胞内カルシウム恒常性の破綻などにより,タンパク質の折りたたみに必要な小胞体内のATPや適切なカルシウム濃度などが低下して,タンパク質の折りたたみ容量が減少することで生じる.他にも,生理的あるいは病理的な分泌タンパク質や膜タンパク質産生の急激な増加や遺伝子変異による立体構造異常タンパク質の産生なども小胞体ストレスを生じさせる.そのような小胞体ストレスに対して,すべての細胞は,小胞体ストレスを感知し,翻訳制御や転写誘導などにより対応する小胞体ストレス応答と呼ばれる機構を備えている.小胞体ストレス応答では,まずタンパク質翻訳の抑制によって新規に小胞体に挿入されるタンパク質を減少させることで,さらなる折りたたみ不全タンパク質の蓄積が防がれる.次に,タンパク質の折りたたみを補助する分子シャペロンを転写誘導することで,すでに存在している折りたたみ不全タンパク質の再折りたたみを可能にし,また折りたたみ不全タンパク質の凝集化も防ぐ.同時に,折りたたみ不全タンパク質を減らすために,折りたたみ不全タンパク質を小胞体内から引き出してユビキチン-プロテアソーム系で分解する小胞体関連分解に関わる因子も転写誘導される.しかし,許容できない高度もしくは長期間の小胞体ストレスの場合には,組織や個体の恒常性維持のため,細胞死が誘導される.小胞体から細胞質や核にシグナルを伝える小胞体ストレス応答の伝達分子は,どの細胞にも普遍的に発現する三つのタンパク質が知られており,これらはいずれも小胞体膜上に存在する一回膜貫通タンパク質である.これには,PERK以外に,IRE1(inositol requiring enzyme-1)とATF6(activating transcription factor 6)があるが,本稿ではPERKに焦点を当てて解説し,IRE1, ATF6,また組織特異的に発現する小胞体ストレスセンサーの機能については他の総説などを参照していただきたい.
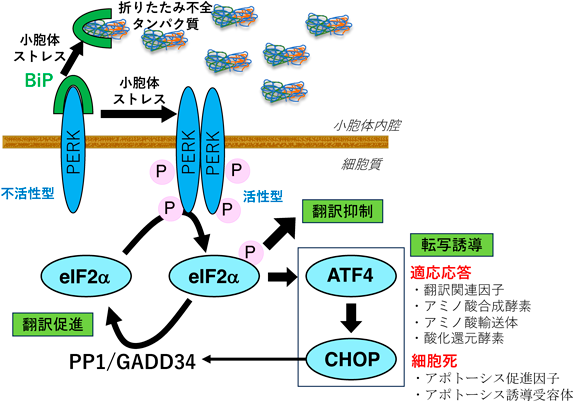
2)小胞体ストレス応答におけるPERKの働き(図1)
PERKは,N末端側が小胞体内腔側に,C末端側が細胞質側にあるタイプI型の一回膜貫通型タンパク質で,セリントレオニンキナーゼとして働く.PERKの小胞体内腔ドメインには分子シャペロンであるBiP(GRP78)との結合部位があり,小胞体ストレスの感知を担う.通常時にはPERKにBiPが結合することで不活性化状態になっているが,小胞体ストレスが生じるとBiPは折りたたみ不全タンパク質に結合しやすいため,BiPがPERKから解離してPERKは単量体から二量体化,さらには多量体化する.それによりPERKが自己リン酸化することによって,セリントレオニンキナーゼ活性を持つ活性化状態になる1–4).活性化したPERKは,翻訳開始因子eIF2複合体のαサブユニット(eIF2α)の51番目のセリン残基をリン酸化する5).リン酸化eIF2αは,継続的な翻訳開始に必要なグアニンヌクレオチド交換因子eIF2Bに強く結合してその活性を阻害することで,ほとんどのmRNAの翻訳開始を抑制し,新たなタンパク質の合成を広範に停止させる6, 7).一方で,複数のuORF(upstream open reading frame)を持つ一部のmRNA,たとえば転写因子ATF4は,eIF2αがリン酸化した状態で翻訳が促進される8, 9).ATF4は,翻訳関連因子やアミノ酸代謝など多様な標的遺伝子を持ち,ストレスに適応するためのPERK経路における重要な転写因子として働く.翻訳抑制が長期間持続すると,生存に必要なタンパク質量を維持することができなくなるので,ATF4はeIF2α脱リン酸化酵素の調節サブユニットGADD34を転写誘導して触媒サブユニットserine/threonine protein phosphatase 1(PP1)によるeIF2α脱リン酸化を促進することで,翻訳を再開させる.このように,後述するストレス顆粒の形成を含めて,PERK経路は翻訳調節を統率している.
PERKの活性化は翻訳調節以外に,小胞体ストレスに適応するための転写誘導の起点にもなる.PERKの下流で誘導されたATF4は,複数のアミノアシルtRNA合成酵素や細胞外からのアミノ酸流入を担うアミノ酸輸送体,アミノ酸合成酵素を転写誘導する.これにより,ストレスからの回復期に,タンパク質合成を再開するのに必要となるアミノ酸供給量を増やすことができる10, 11).加えて,ATF4は抗酸化物質グルタチオンの合成に必須であるアミノ酸量を増すことで,細胞に活性酸素種などによる酸化ストレスに対しても抵抗性を付与する12).特に小胞体ストレス下で,小胞体内の折りたたみ不全タンパク質を小胞体関連分解によって分解するには,ジスルフィド結合を還元して細胞質へ輸送する必要があるので,これに必要な還元力にグルタチオン増加が寄与すると考えられている.
ATF4以外のPERK下流の制御因子の探索については,翻訳されているmRNAを一塩基レベルで解析できるribosome profiling法,近接依存性標識法と高精度な質量分析を用いた分子間相互作用解析やCRISPRを利用したゲノムワイドスクリーニングなどさまざまな方法で現在も試みられている.たとえば,ゲノムワイドCRISPRスクリーニングによってPERK経路において翻訳回復機構に寄与するQRICH1と呼ばれる因子が同定された13).QRICH1は,ATF4と同様にuORFを介した翻訳制御を受けて発現上昇し,転写共役因子として翻訳や分泌に関わる遺伝子の発現を一様に上昇させることが示されている.
また,PERK経路は小胞体ストレスによる細胞死においても,中心的な役割を果たす.たとえば,小胞体ストレス応答の後期には上記のeIF2α脱リン酸化によって翻訳回復が起こるが,慢性的もしくは長期的な小胞体ストレスでは翻訳回復までに小胞体環境が改善しておらず,このミスマッチによる過剰翻訳は折りたたみ不全タンパク質のさらなる蓄積や酸化ストレスを引き起こしてしまい,細胞死が誘導される10, 11).翻訳調節以外では,転写因子CHOPに代表される転写誘導を伴うアポトーシスがあげられる.CHOPの下流にはアポトーシス促進因子Bim14)やアポトーシス誘導受容体DR515)などアポトーシス実行因子が含まれている.これ以外の因子も数多く報告されているが,生死の運命決定や細胞死のモード決定のメカニズムなどまだ未解明な部分が残されている.
小胞体は,細胞内で最も広い膜表面を持つオルガネラで,ほとんどすべてのオルガネラと接触することから,オルガネラ連関でのハブとして機能することが示唆される.PERKは,小胞体ストレス応答の一経路として,タンパク質工場としての小胞体の機能維持に関わるが,他のオルガネラの機能調節にも関与することがわかってきた.それは,小胞体ストレスと関連する形に加えて,小胞体ストレスとは一見独立した形でも起こり,細胞機能のみならず,細胞の生存や細胞死に関わることがわかってきている.現在までに報告されているPERKによるミトコンドリア,リソソームやオートファゴソームおよびその他のオルガネラの機能制御について,以下に述べる.
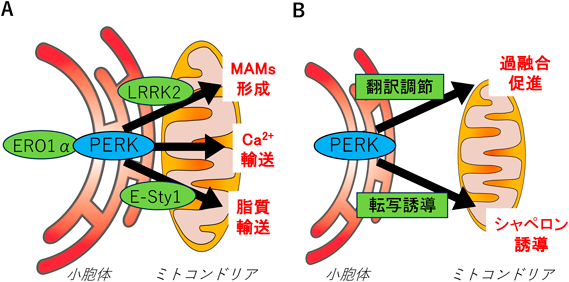
1) ミトコンドリア機能制御におけるPERKの働き(図2)
小胞体とミトコンドリアの接触部位であるmitochondria-associated ER membranes(MAMs)は,歴史的に最も早く見いだされたオルガネラ接触領域である.PERKによるミトコンドリア機能制御には,MAMsに関連する機構とMAMsとは関連性がない機構がこれまでに報告されている.
MAMsが関連する機構は,小胞体局在タンパク質として知られていたPERKが,遠心法にて分離されたMAMsにも豊富に存在するという発見によって,最初の扉が開かれた16).PERKがMAMsの構成因子であることは,ミトコンドリアの融合やミトコンドリアと小胞体のつなぎ止めに関わるタンパク質MFN2(Mitofusin 2)によるpull-down実験で,MFN2と直接相互作用することからも示されている17).さらに,PERKがMAMsの形成にも関与する可能性が,MAMsの構成因子であるLRRK2とPERKとの相互作用解析から提唱されている18).すなわち,PERKがMAMsの構成因子のE3ユビキチンリガーゼをリン酸化することで,MitofusinなどのMAMs構成因子のユビキチン-プロテアソーム分解が促進され,小胞体とミトコンドリアの相互作用が低減すると報告されている18).一般にMAMsは,カルシウムイオンや脂質の輸送を介してミトコンドリアの形態や機能の維持に働くと考えられている.PERKは小胞体とミトコンドリアの間の物質交換に関与するのだろうか? 小胞体とミトコンドリアはともに細胞内におけるカルシウムイオン貯蔵庫であり,刺激に応じて小胞体から放出されたカルシウムイオンをミトコンドリアが取り込むことで,ミトコンドリアでのATP合成が促される.このことは,小胞体のカルシウムイオンチャネルであるIP3Rが,ミトコンドリアのカルシウムチャネルであるVDACと,GRP75を介した複合体を形成して二つのオルガネラを繋留していることに裏づけられている.小胞体ストレスの初期では,PERKは小胞体酸化酵素であるERO1αと複合体を形成して,小胞体からミトコンドリアへのカルシウムイオン輸送を促進する19).一方,脂質に関しては,PERKは,MAMsに脂質輸送タンパク質であるExtended-Synaptotagmin 1(E-Syt1)をリクルートするための足場として機能しており,PERKを欠損するといくつかのミトコンドリアリン脂質が減少して,ミトコンドリア呼吸機能が低下する20).これらの結果を合わせるとPERKは,定常状態とストレス負荷時の両方でMAMsの形成や機能を制御して正常なミトコンドリア機能を維持していると考えられる.
他方,MAMsを介さずにPERKがミトコンドリア機能に影響を与えることもわかってきている.以前よりさまざまなストレス負荷によりミトコンドリアは過融合する現象が知られていた.小胞体ストレスでのミトコンドリアの過融合は,PERK活性化によるeIF2αリン酸化を介した翻訳制御によって引き起こされることが報告されている21).さらにPERK経路の活性化は,小胞体ストレスによるミトコンドリアの形態の制御だけでなく,ミトコンドリア機能に関わるミトコンドリア関連遺伝子発現の制御にも関係する.すなわち,PERKが活性化すると,下流の転写因子ATF4を介した転写誘導により,ミトコンドリア呼吸鎖複合体形成に必要なミトコンドリアシャペロンの発現を調節することでミトコンドリア呼吸機能を維持することが報告されている21, 22).PERK単独の過剰発現でもミトコンドリアの断片化を誘導することが報告されていることから,PERKが積極的に小胞体ストレス時のミトコンドリア形態の維持や変化に関与している可能性があり,MAMsを介さないPERKによるミトコンドリア機能の制御機構のさらなる解明が期待される.
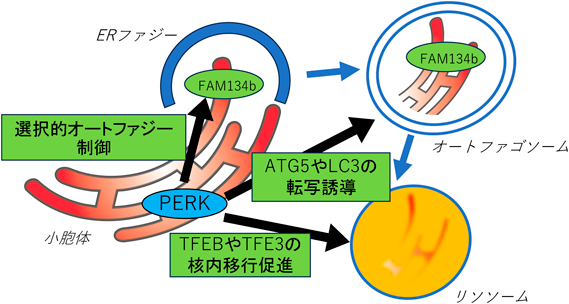
2) リソソームやオートファゴソーム機能制御におけるPERKの働き(図3)
オートファジーは,オルガネラ分解の主要な経路であり,小胞体ストレスで多量の折りたたみ不全タンパク質が蓄積すると,オートファジーが誘導されることも古くから示されてきた23–25).オートファジーではオートファゴソームと呼ばれる脂質二重膜で分解対象が包まれて,分解の場であるリソソームに輸送されるが,オートファゴソームの形成に必要となる新たな脂質膜の供給元は小胞体である.最近の研究から,PERKはリソソームやオートファゴソーム形成の調節を介してオートファジー機構にも関与することが明らかとなってきている.リソソームは多くの細胞に普遍的に存在するが,その生合成や増加にはマスター転写因子TFEBやTFE3が重要で,これら転写因子は,リン酸化を介した核内外への移行によって活性が制御されている.小胞体ストレスによるTFEBやTFE3の核内への移行には,PERKによるeIF2αリン酸化が必須であることがわかった26).これはATF4の誘導を必要とせず,脱リン酸化酵素calcineurinによりTFEBやTFE3が脱リン酸化されることによって核内移行が誘導され,リソソームの合成に必要な遺伝子の転写が促進される27).加えて,オートファゴソーム形成に必要なATG5やLC3などの遺伝子発現もPERK経路を介して誘導されることも報告されている28, 29).これらPERKのリソソームやオートファジーにおける機能は,細胞レベルにおいて高度に蓄積したり凝集したりした異常タンパク質の分解を通して小胞体ストレスに対する生存率を高めると考えられる.
PERKは転写誘導でオートファジー容量を増加させる以外に,細胞が不必要と判断したものだけを選択的にオートファゴソームに取り込ませて分解する選択的オートファジーの制御にも関与する可能性がある.小胞体に選択的なオートファジーであるERファジーは,制御する受容体が多く同定されており30),ERファジー受容体の一つであるFam134bを欠損した細胞は小胞体ストレスに対して脆弱になることから31),近年注目されている.これまでに,グラム陽性細菌が感染した細胞に認められるERファジーにおいてPERKやIRE1がオートファゴソームに濃縮されるという報告32)や,小胞体に蓄積して小胞体ストレスを引き起こす突然変異ロドプシンがIRE1経路の活性化による小胞体の選択的オートファジーで分解され,PERK経路の活性化はその分解を抑制するとの報告33)もあり,PERKを含めた小胞体ストレス応答と選択的なオートファジーの関わりが示唆されるも,一般化するのは容易ではない.さまざまな働きが報告されているのは,オートファゴソーム形成を含めたオートファジー経路において,細胞種や状況によってPERKの役割が異なるからかもしれない.今後,基質や細胞種の詳細な検討によって,オートファジーにおけるPERKの役割がさらに明らかとなっていくだろう.
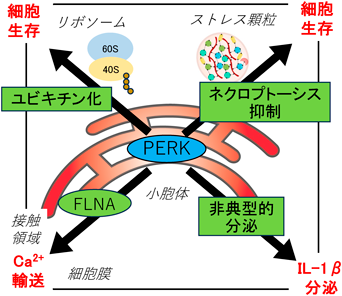
3) その他のオルガネラ機能制御におけるPERKの働き(図4)
ミトコンドリアやオートファジー関連以外でのPERKによるオルガネラ機能制御としては,PERKによる小胞体膜と細胞膜の接触領域の形成が報告されている.これは,近位依存性ビオチン標識(BioID)技術を用いたPERKと相互作用するタンパク質の網羅的探索から明らかになった.PERKの相互作用因子として同定された細胞骨格形成に関わるFLNAは,PERKと結合することでF-アクチンネットワークをリモデリングして,小胞体膜と細胞膜の接触領域を形成する34).この仕組みによって,MAMsの場合と同様にカルシウムイオンの輸送が効率化されると考えられる.
オルガネラは,脂質二重膜を持つ細胞内の構造体と一般には定義されるが,ここでは細胞内で特定の機能を果たす構造体と広く定義する.ストレス顆粒は,細胞がストレス状態にあるときに,主に翻訳停止中のmRNAとそれに結合するタンパク質から構成される脂質二重膜を持たないオルガネラである.翻訳停止によりmRNAを含む翻訳開始複合体が蓄積すると,ストレス顆粒が形成されるので,翻訳を停止させるeIF2αリン酸化は,ストレス顆粒形成で中心的な役割を果たす.さまざまなストレス負荷でeIF2αがリン酸化されるが,PERKはその中でも小胞体ストレスで活性化し,異常タンパク質の合成を止めると同時にストレスからの回復に備えてストレス顆粒によりmRNAを分解から防ぐと考えられている.最近,PERKの活性化によるストレス顆粒の形成は,RIPK1-RIPK3-MLKL炎症シグナルを抑制することで,マクロファージをネクロプトーシスによる細胞死から保護することが報告された35).また,詳細なメカニズムは不明なものの,PERKは小胞体ストレス時にリボソームの40Sサブユニットの構成因子をユビキチン化することで,細胞の生存に関与することも報告されている36).これらは,PERKが担う翻訳調節に関連したオルガネラ機能制御を介したストレス適応応答と考えられる.
小胞体は分泌タンパク質の合成の場であり,分泌タンパク質は基本的にはシグナル配列を持つことで小胞体内へと翻訳と協調して挿入されるが,IL-1βやHMGB1/2など一部のタンパク質はシグナル配列を持たず,典型的な分泌経路を介さず細胞外へと分泌される.このような非典型的分泌には細胞内小胞輸送を介するものがあると考えられており,PERKの阻害によってIL-1βの非典型的分泌過程が阻害されることが報告されている37).これらは,PERKが担うタンパク質輸送に関連した炎症応答とも考えられ,どのようなオルガネラが関係するかを含めてさらなる研究が望まれる.
1) タンパク質品質管理制御を介したPERKによる個体機能調節
PERKが関与する細胞・生体機能調節や疾患は多岐にわたるが,ここではPERKによるタンパク質品質管理が重要な働きを示す代表例として,インスリン分泌と骨形成におけるPERKの役割をまず説明する.ヒト早期乳児期にインスリン依存型糖尿病症状を呈するWolcott–Rallison症候群の原因遺伝子としてPERK遺伝子の変異が同定されたことが,PERKの個体機能さらには病気との関連性を示した最初の報告である38).このことは,実際にマウスで全身のPERKを欠損すると,膵臓β細胞の消失に伴う重度の糖尿病様症状を呈すことで確認され39),膵臓β細胞がさまざまな臓器の中で小胞体ストレスに脆弱であることを示唆している.PERKによる膵臓β細胞でのインスリン合成の恒常性維持には,分子シャペロン40)あるいは分泌輸送41)が翻訳調節よりも重要とする論文もあるが,膵臓β細胞は正常血糖を維持するために多量のインスリンを小胞体で合成する必要があるので,翻訳調節が最も重要なのではないか42)と考えている.また,Wolcott–Rallison症候群は糖尿病の症状以外にも多発性骨端異形成や骨減少を呈するため,PERKは骨形成にも重要であると考えられる.骨芽細胞は骨形成のために多量のコラーゲンを分泌する必要があるが,PERKを欠損したマウスはコラーゲンの異常な局在と発現量の減少がみられ,また骨芽細胞の増殖や分化が阻害されて骨減少が引き起こされた43).また,我々もPERK欠損マウスの解析から,軟骨細胞での小胞体内でのコラーゲン合成にPERKが必須であることを報告している44).これらの研究結果は,構造決定に重要なジスルフィド結合あるいはコラーゲンのように複雑な構造を有する分泌タンパク質の正常な合成・分泌に,PERKによるタンパク質品質管理が必須であることを示している.
分泌タンパク質を産生する内分泌系以外では,脳神経系における小胞体ストレス応答およびeIF2αリン酸化の重要性を示す多くの研究が報告されている.しかし,興味深いことにPERKを欠損しても重篤な症状は認められず,PERK以外のeIF2αリン酸化酵素がその翻訳調節機能を代償するという報告もあり,神経系におけるPERKの役割は十分には解明されていない45, 46).さらに,神経変性疾患は凝集体を伴う疾患も多く,小胞体ストレスや小胞体ストレス応答のそれぞれの経路の関与が多く示されている.神経変性疾患におけるPERK経路の意義についてはここではすべてをあげることはできないため,他の総説などを参照していただきたい47, 48).
また,iPSC(induced pluripotent stem cells)の初期化の際に,PERKは小胞体恒常性の維持を通して多能性の獲得に寄与するとの報告もある49).PERKは,さまざまな細胞に分化する場面や細胞種特異的な機能を発揮する場面で,小胞体内の変化に対応して小胞体恒常性を維持するために機能していると推察される.細胞が分化して細胞種特異的な機能を獲得する過程において細胞内の小胞体も形態や内部で産生されるタンパク質の変化など多くの影響を受けるが,PERKはそのような分化に伴う小胞体の変容に適応するための機能も持つと推察される.
2) オルガネラ機能制御を介したPERKによる個体機能調節
前述のPERKのホモ結合変異によるWolcott–Rallison症候群は,新生児期に糖尿病を発症し,幼児期には骨形成異常と成長障害を生じ,学童期以後では精神遅滞や心血管異常の合併もみられる38).患者の臓器をオルガネラレベルで解析すると,小胞体以外にミトコンドリアの障害が観察されている50, 51).興味深いことに,呼吸鎖複合体Iの消失50)や構造異常51)といったミトコンドリア変化は,すべての臓器で観察されるわけでなく,臓器ごとに障害の種類が異なっていた.このようなWolcott–Rallison症候群で認めた発症時期が異なる多臓器障害からも,臓器ごとに異なるオルガネラ機能制御の存在がうかがいしれる.
まずはミトコンドリア機能制御と関連したPERKによる個体機能調節に関する報告から紹介したい.アルコール性脂肪肝炎の増悪に,PERK/eIF2α/ATF4軸を介するミトコンドリア機能制御が関与することが見いだされている.その分子機構としては,PERKの活性化で発現誘導されたATF4が,ミトコンドリア合成促進転写因子TFAMのプロモーター領域にある転写因子NRF1結合部位に結合して,NRF1によるTFAM誘導を抑制することでミトコンドリアの量と機能を低下させると報告されている52).一方,最もミトコンドリアが豊富な臓器である褐色脂肪組織の成熟に,eIF2α/ATF4軸を介さないミトコンドリア機能制御が関与することが見いだされている.この分子機構として,褐色脂肪細胞分化に伴って活性化したPERKが,ATF4ではなく転写因子GABPαの転写活性を高めることで,ミトコンドリア構成タンパク質を転写誘導することを我々は報告している53).さらに褐色脂肪細胞の研究では,PERKがO結合型糖転移酵素OGTを直接リン酸化することで,ミトコンドリアへのタンパク質輸送機能を促進する転写誘導を介さないミトコンドリア機能制御機構も報告されている54).
褐色脂肪細胞ではPERKがミトコンドリア量ではなくクリステ構造の形成に重要であることが二つの研究成果に共通しているが,ミトコンドリア量の制御が重要な肝臓とは異なっており,臓器ごとでの違いを認める.
ミトコンドリア機能制御以外に,オートファジー機能制御と関連したPERKによる個体機能調節もわかってきた.糖タンパク質として分泌されるトロンボスポンジン1は多彩な働きがあるが,過剰に合成されるとPERKを活性化して,致死性の心筋萎縮を起こすことが発見された.この分子機構として,eIF2α/ATF4軸を介したオートファジーが誘導され,タンパク質合成を上回る分解により萎縮が発生すると報告されている55).一方,がん細胞では,PERK活性化によるオートファジー促進が,がん微小環境での低酸素条件でがん細胞の生存を助けることが報告されている28).PERK活性化によるオートファジー促進は必ずしも疾患惹起的に働くとは限らず,実際にPERKを活性化させる低分子化合物の投与で,オートファジーが誘導されて神経変性疾患の原因となるアミロイド形成を減少するという報告もある56).
以上の結果は,PERKによるオルガネラ機能のファインチューニングが,個体機能調節に必要であることを示している.オルガネラの量やオルガネラの働きは,細胞種によって差異があり,どのようにファインチューニングすべきかなども今後明らかする必要がある.
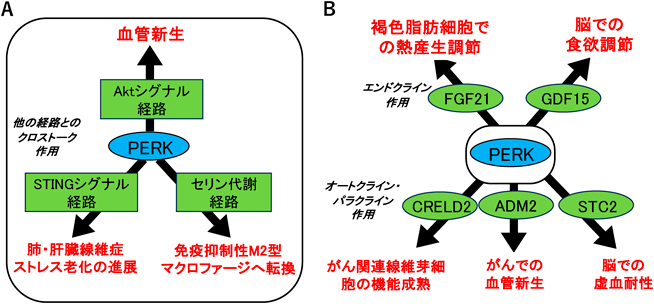
3)コンテクスト依存的なPERKによる個体機能調節(図5)
PERKの持つ,細胞種,内部環境,外部環境といったコンテクストに依存した個体機能調節が明らかになってきた.これは,細胞自律的な機能制御と細胞間コミュニケーションを介した機能制御の二つに大きく区分できる.まずは,他のシグナル伝達系とのクロストークによる細胞自律的な機能制御から説明する.血管内皮細胞では,血管新生因子VEGFがPLCγを介してPERKを含む小胞体ストレス応答経路を活性化させ,Aktシグナル経路とのクロストークを介して血管新生に働く57).また,DNAウイルスなどの病原体に対する免疫応答の起点となることが一般的に知られている小胞体膜タンパク質STINGは,PERKを活性化してリン酸化eIF2α依存的な翻訳制御により細胞老化と肺や肝臓での線維症を進展させる58).さらに,シグナル伝達だけでなく,代謝物であるアミノ酸を介した細胞機能制御も報告されている.たとえば,PERK下流のATF4はアミノ酸代謝関連遺伝子の発現を誘導するが,マクロファージでは特にセリン合成酵素の発現制御を介して免疫抑制性であるM2型マクロファージへの転換が促進される59).
さらに,PERK経路の転写誘導は,ホルモンやサイトカインの分泌誘導を介して,細胞間や臓器間のコミュニケーションにより生体の恒常性維持に寄与することが明らかになってきた.我々は,これまでに,PERK経路の活性化によるeIF2αのリン酸化が,内分泌ホルモンであるFGF21やGDF15などを遺伝子誘導することで,PERKが活性化した組織から他の組織にエンドクライン的に作用し,褐色脂肪細胞での熱産生や脳での食欲を調節することを報告してきた60, 61).さらに,がん細胞では,細胞骨格制御シグナルであるROCKがPERK経路を選択的に活性化することで,がん関連線維芽細胞のリクルートと機能成熟をもたらし,がんの進展に寄与する62).このROCKによるPERKの活性化は,ATF4を介してCRELD2を誘導し,分泌されたCRELD2がパラクライン的にがん細胞から線維芽細胞に作用する.PERK活性化によりATF4によって誘導されるサイトカインとして,Adrenomedullin 2(ADM2),Stanniocalcin 2(STC2)などがオートクラインあるいはパラクライン的に作用し,がんでの血管新生や脳での虚血耐性に働く可能性が報告されている63, 64).
これらの結果は,PERKがすべての細胞に普遍的な小胞体でのタンパク質品質管理以外に,翻訳調節,転写誘導さらに他のシグナル経路とのクロストークによって細胞種と状況に応じた機能調節に働くことを示しており,今後のさらなる研究が待ち望まれる.
これまでの精力的な研究から,PERKが小胞体ストレス応答の伝達タンパク質の一つとして,小胞体の機能維持や小胞体ストレス誘導性の細胞死に関わることが明らかになっている.しかし,ここで紹介したように,PERKは小胞体にとどまらずにさまざまなオルガネラ機能と生体調節機構に関与することが,次々と明らかになっている.特に,現在注目されているオルガネラどうしの連携や細胞間コミュニケーションなどへの積極的な関与がわかってきた.さらに近年,小胞体ストレス以外にもPERKを活性化させる意外な機構が次々と報告されている58, 62, 65–67).これらの詳細な分子機構については不明な点も多々あることから,PERKのオルガネラ機能制御に関しては,今後多くの発見があることは間違いない.
本稿でも紹介したように,タンパク質恒常性(プロテオスタシス),オルガネラ,生理機能を統合する研究の重要性が高まっている.実際,小胞体を含めた細胞内のタンパク質恒常性の観点から生体機能や老化を含めた疾患発症機序の解明を目指す研究が盛んに行われるようになってきた.生体は多種多様で特異的な機能を持った細胞種で構成されており,それぞれのアイデンティティー維持を支えるオルガネラの役割にも細胞種ごとに多様性があると予想される.今後のPERK機能の解析においては,細胞特異性の観点を取り入れることで,小胞体を起点としたオルガネラ機能制御の生理的意義やその破綻が引き起こす疾患や加齢の機序解明につながることが期待される.