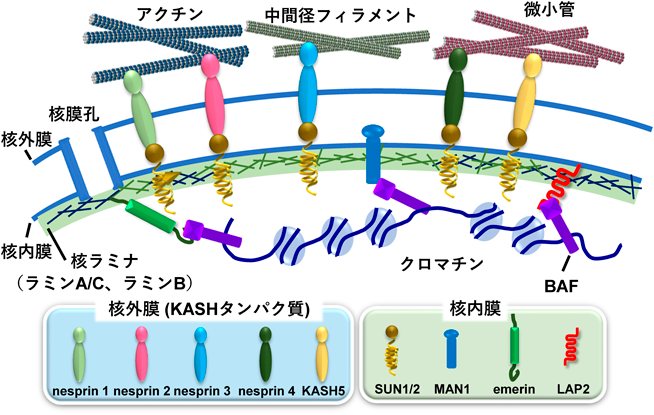
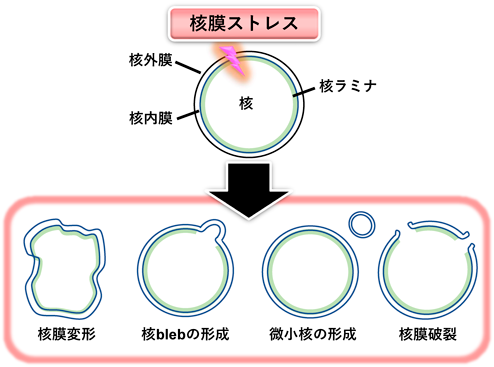
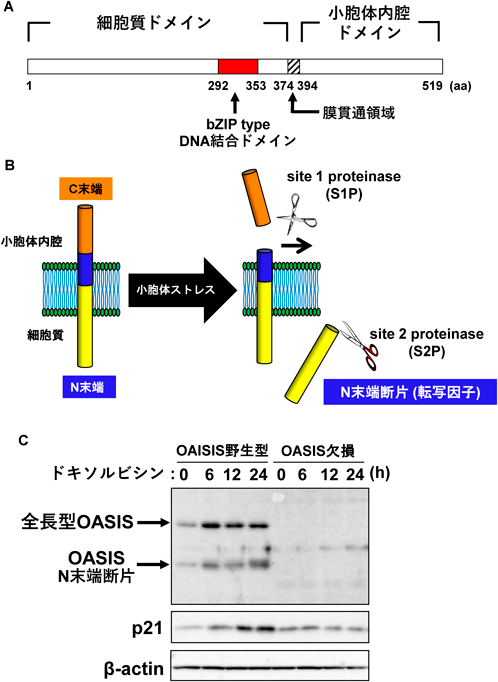
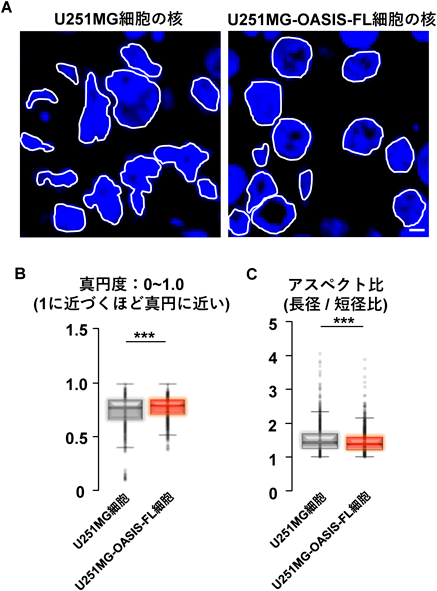
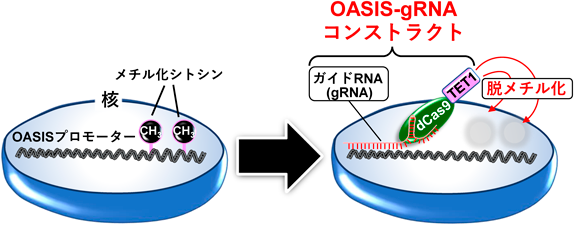
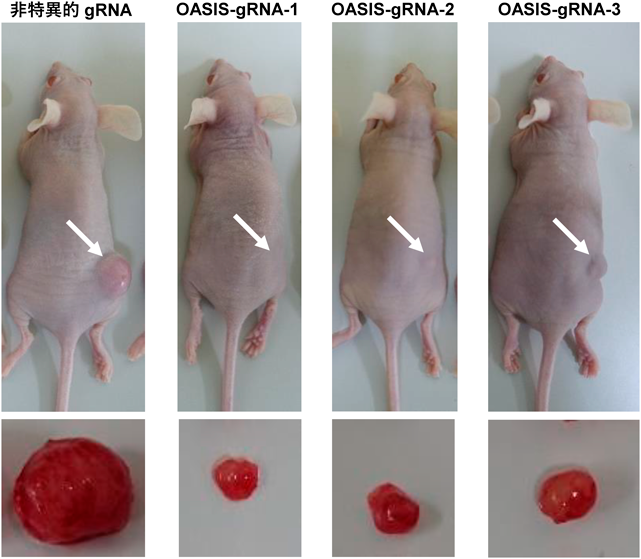
小胞体–核の機能連携をつかさどる膜貫通型転写因子OASISRegulation of functional communication between endoplasmic reticulum and nucleus by transmembrane transcription factor OASIS
広島大学大学院医系科学研究科分子細胞情報学Department of Biochemistry, Institute of Biomedical & Health Sciences, Hiroshima University ◇ 〒734–8553 広島県広島市南区霞1–2–3 ◇ Kasumi 1–2–3, Minami-ku, Hiroshima City, Hiroshima 734–8553, Japan