2. ヒトノイラミニダーゼ1(NEU1)と関連タンパク質
1)NEU1とは
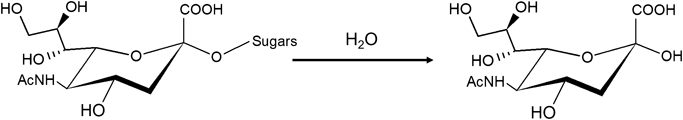
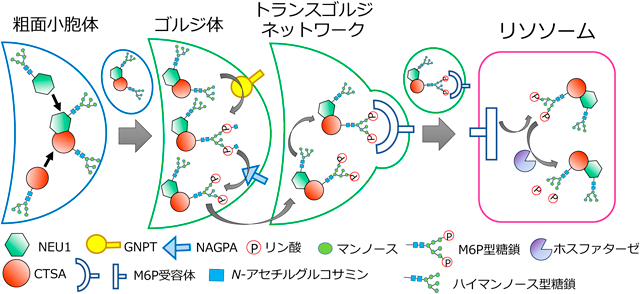
ヒトの細胞内には,NEU1~NEU4の4種類のノイラミニダーゼのアイソザイムが存在する(表1)5).それらのうち,NEU1は酸性領域に至適pHを持つリソソーム性グリコシダーゼの一種で,不要になったシアル酸含有糖鎖を異化分解する働きを持つ6).NEU2は主に細胞質に,NEU3は主に細胞膜付近に,NEU4はミトコンドリアなどに存在している5).NEU1は単独では活性を示さず,カテプシンA(CTSA)と会合することで活性化される7).またNEU1はアスパラギン結合型(N型)糖タンパク質として小胞体内腔で生合成されるが,単独ではあまりリソソームまで輸送されず,CTSAと会合することで輸送が促進される7).一般的に,リソソーム酵素には末端マンノース-6-リン酸型のN型糖鎖(M6P型糖鎖)が付加され,それを目印としてリソソームまで輸送される.具体的な分子メカニズムを解説すると,リソソーム酵素は小胞体内腔で生合成される際に,N型糖鎖の一種であるハイマンノース型糖鎖が付加される.その後,ゴルジ体内腔まで輸送されてN-アセチルグルコサミン-1-ホスホトランスフェラーゼ(GNPT)によりUDP-GlcNAcを基質として非還元末端にマンノース-6位リン酸-N-アセチルグルコサミンの構造が作られる.続いてホスホジエステラーゼであるN-アセチルグルコサミン-1-ホスホジエステルアルファ-N-アセチルグルコサミニダーゼ(NAGPA)によりGlcNAc残基が除去されてM6Pが露出することでM6P型糖鎖となる.このように,M6Pの付加はGNPTがリソソーム酵素を認識することから始まるが,GNPTがどのようにリソソーム酵素を認識しているのかはいまだ不明である.NEU1はGNPTに認識されないため,ハイマンノース型糖鎖がM6P型糖鎖に編集されることがない7).そのため,単独ではリソソームに移行できず,CTSAとの会合を必要とする(図2).なお,NEU1の遺伝的欠損症としてシアリドーシスが知られている7).また,NEU1はリソソーム膜に局在するリソソーム関連膜タンパク質1(LAMP1)のリソソーム内腔側シアル酸含有糖鎖からシアル酸を除去することでリソソームのエキソサイトーシス,すなわち細胞膜とリソソームの融合を制御していることが示唆されている8).
表1 ヒトノイラミニダーゼのアイソザイム | NEU1 | NEU2 | NEU3 | NEU4 |
|---|
| 細胞内局在 | リソソーム | 細胞質 | 形質膜 | ミトコンドリアなど |
| 至適pH | 4.6 | 6.0 | 4.6および6.0 | 4.6 |
| その他特徴 | 活性化にはカテプシンAとの会合が必要 | 結晶構造が決定されている | ガングリオシド特異的 | 2種類のアイソフォームがある |
2)CTSAとは
CTSAはリソソーム性カルボキシペプチダーゼである.NEU1と会合してNEU1を活性化する.さらに,β-ガラクトシダーゼ1を他のプロテアーゼによる分解から保護する機能も併せもつ9).まずCTSAは小胞体内腔で54 kDaのCTSA前駆体として生合成される.その後はゴルジ体に輸送され,GNPTに認識されてM6P型糖鎖が付加される.さらに,トランスゴルジネットワーク(TGN)に輸送され,TGNに存在するカチオン依存性M6P受容体に結合し,小胞輸送によりリソソームまで運ばれる.CTSA前駆体は後期エンドソームからリソソーム内で他のプロテアーゼによるプロセッシングを受け,32 kDaと20 kDaのサブユニットがジスルフィド結合でつながった成熟体となり,ペプチダーゼ活性を示すようになる10).CTSAのペプチダーゼ活性は,生理活性ペプチドのC末端トリミングに寄与していることが示唆されている11).なお,CTSAが先天的に欠損する遺伝性疾患としてガラクトシアリドーシスが知られている11).
3)ヒトβ-ガラクトシダーゼ1(GLB1)
GLB1も,NEU1やCTSAと複合体を形成していることが知られているグリコシダーゼである.近年,げっ歯類のGLB1とCTSAの二者複合体の構造が決定され,三角形のような構造で会合していることが判明した(PDB ID:7KDV)12).GLB1は,CTSAと同様に小胞体で生合成された後,ゴルジ体内腔でM6P型糖鎖が付加されてリソソーム内へと輸送される.リソソーム内では,糖タンパク質由来の糖鎖やガングリオシドを分解する働きを持つ.GLB1はCTSAと会合することで他のリソソーム内プロテアーゼに分解されることから保護されるが,げっ歯類についてはCTSAへの依存度はヒトよりも小さいと報告されている13).NEU1とは異なり,GLB1は単独でも活性を示す.GLB1の遺伝的欠損症として,GM1ガングリオシドーシスが知られている12).
1)細胞内タンパク質結晶化とは
タンパク質の結晶化といえば,クロマトグラフィーなどで高純度に精製したタンパク質を構造解析のためにバッファー中で徐々に結晶化させていくのが一般的である.このとき,夾雑タンパク質の存在は結晶化を阻害することがよく知られている.しかし,生物の細胞内という他のタンパク質が大量に存在する環境下でも,ごく一部のタンパク質は結晶化することが知られている.哺乳類細胞にサイトメガロウイルスプロモーター,CAGプロモーターなどの強力なプロモーター制御下でNEU1を過剰発現させると,NEU1は細胞内で自己会合し,小胞体内腔で結晶化する(図3)14, 15).NEU1以外にも,細胞内タンパク質の結晶化の例はまれではあるがいくつか知られている.なお,タンパク質に限らない細胞内結晶という点でいえば,植物細胞内でシュウ酸カルシウムが結晶化しており,光学顕微鏡で容易に観察できることは一般的に広く知られているが今回は割愛する.本稿では,タンパク質の細胞内結晶とオルガネラの関係にフォーカスして概説する.
2)過剰発現系におけるタンパク質結晶化
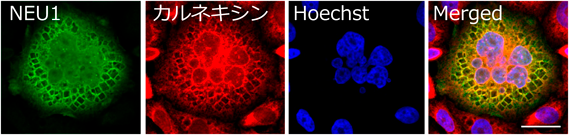
哺乳類細胞においては,これまで述べてきたNEU1だけでなくヒト免疫グロブリンIgG16),アクチン骨格形成に関与するキナーゼと制御因子であるPAK4–Inka1複合体17),サンゴ由来蛍光タンパク質Xpa18)などを過剰発現させると細胞内結晶を生じることが知られている.このうち,NEU1, IgGはもともと粗面小胞体内腔で生合成されるタンパク質であるため細胞内結晶も小胞体内腔で生じる.これは,細胞内結晶表面と小胞体マーカータンパク質カルネキシンとの共局在がみられること14–16),電子顕微鏡観察においてリボソームが付着した脂質二重膜が結晶表面を覆っている14)様子が観察されていることから明らかになった.一方,セリン/スレオニンプロテインキナーゼPAK4とその制御タンパク質であるInka1の複合体PAK4–Inka1やXpaはもともと細胞質で合成されるタンパク質であるため細胞内結晶化も細胞質で起こる.PAK4–Inka1複合体の結晶についてはPAK4やInka1のN末端にGFPを融合させても,GFP–Inka1とPAK4,あるいはInka1とGFP–PAK4の組合わせであれば細胞内結晶を生じるほどに結晶性が高い17).
PAK4–Inka1のように,GFPと融合させても結晶化するタンパク質として,レオウイルスのμNSタンパク質がある.ニワトリ胚由来線維芽細胞で針状の結晶,あるいは凝集体のような構造物を生じることが知られている.この結晶も,細胞質で生じる19–21).
Xpaはもともと結晶化しないサンゴ由来緑色蛍光タンパク質の変異体をスクリーニングする中で副産物として得られたタンパク質である.Xpaについては,細胞内結晶への細胞の応答まで調べられている.Xpaの結晶を電子顕微鏡で観察すると脂質膜で覆われており,それはリソソーム膜であることが判明している.リソソーム内で結晶化するのか,それとも細胞質で結晶化するのか調べたところ,結晶表面はユビキチンやp62で染色されることから細胞質で結晶が生じ,それが選択的オートファジーによってリソソーム膜に包まれることが示唆された.選択的オートファジーとは,プロテアソームで分解できないようなユビキチン化タンパク質,あるいはオルガネラをp62が認識し,p62を目印としてオートファゴソーム膜が取り囲む機構のオートファジーである.すなわち,細胞内結晶をオートファゴソーム膜に隔離するには,対象物をユビキチン化するユビキチンリガーゼなどが必要であるが,どのような分子機構で細胞内結晶という自然界でも非常に類いまれなる巨大構造体を認識しているのかは不明である.しかしながら,この研究は細胞内でタンパク質が結晶化したあと結晶の運命が調べられた数少ない一例である.また,Xpaの結晶化の様子もタイムラプスにより撮影されている.従来は結晶というものは数時間~数日かけてゆっくりと成長するものであると思われていたが,Xpaの場合はわずか数分と予想以上に速く結晶化することが明らかになっている18).これは著者の経験談であるが,細胞内NEU1結晶もプラスミドベクター導入後3日目~4日目の間で急に結晶の数が増えており,案外細胞内結晶というのは速やかに形成されるのかもしれない.
哺乳類細胞以外では,昆虫細胞内で結晶化するタンパク質がいくつか知られている.Sf 21細胞内におけるヒトカルシニューリン22),Sf 9細胞内におけるトリパノソーマカテプシンB23),イノシンモノリン酸デヒドロゲナーゼ24)などが知られている.このうち,トリパノソーマカテプシンBは小胞体内腔で,それ以外は細胞質で結晶化する.また,トリパノソーマカテプシンBは細胞内結晶を利用してX線結晶構造解析が行われており,Protein Data Bankでその立体構造をみることができる(PDB ID:4HWY, 4N4Z)23).
3)自然界における細胞内結晶
自然界でも細胞内結晶はまれに見つかることがある.特に昆虫に核多角体病を引き起こす,バキュロウイルス科の一種である核多角体病ウイルスのポリヘドリンタンパク質は分子生物学だけでなく,農業の分野でも有名である25–28).核多角体病ウイルスは,主にガの幼虫に消化管を経て感染するDNAウイルスである.養蚕業に深刻なダメージを与える致死性の高いウイルス感染症として知られている.感染した昆虫の体内ではウイルス粒子が大量に作られ,血液は白濁する.感染個体は次第に動きが鈍り,皮膚が黒変する.体内は溶けて液状となり,皮膚がもろくなって破れ,増殖したウイルスがまき散らされる.このとき,ウイルスはそのままの裸の状態ではなくポリヘドリンが結晶化した多角体の中に包埋された状態である.頑丈な結晶の中に埋まることで外部からの熱や物理的圧力,酸,化学物質などからウイルスが守られる.ポリヘドリンの結晶はそのまま植物の葉や地上に数年にわたって残留する.食物に紛れて結晶が昆虫に食べられると,アルカリ性である昆虫の消化管内で結晶が溶解して内包したウイルスを放出する.なお,哺乳類は消化管が酸性であるため結晶が解けることはなく,溶けたとしてもウイルスが感染することはない.
ポリヘドリンの結晶に内包されたウイルスは非常に安定であるという性質を利用して,自然界にもともと存在する上に昆虫への選択性が高いことから環境にやさしい農薬として市販されている.なお,ウイルスが感染した際にはポリヘドリンタンパク質は昆虫細胞が作り出すタンパク質のうち多くを占めるほどに発現するが,これはポリヘドリンプロモーターが非常に強力なためである.このプロモーター下流に目的タンパク質の遺伝子をつなぎ,バキュロウイルスにパッケージングして昆虫細胞に感染させて用いるバキュロウイルス-昆虫細胞発現系は有用タンパク質の簡便な大量生産技術として広く用いられている29).このように,核多角体病ウイルスはその特異な性質が広く応用されている.また,生じる理由があまり明確ではない細胞内結晶が多い中で,上述のようにポリヘドリン結晶は明確な役割を持った例である.
他に自然界でも起こるタンパク質として,メタノール資化性酵母であるHansenula polymorphaのアルコールオキシダーゼ(AOX)がある30).AOXはH. polymorphaの培養液中にメタノールを加えることで発現が誘導される.AOXが十分に発現すると,細胞質でそのまま結晶化するか,あるいは細胞質からPex5によってペルオキシソームに輸送され,ペルオキシソーム内でも結晶化する31).
ヒトにおいても自然に細胞内結晶化が起こる例が発見されている.好酸球の細胞質でみられるCharcot-Leyden結晶がその例である32).数十µmの長さの六角錐が底面でくっつきあったような形状をしている.Charcot-Leyden結晶を構成しているのはガレクチン10というタンパク質である33).ガレクチン10は,普段は細胞質にある程度偏在して分布しているが,アレルギー性鼻炎などの際に好酸球がエトーシスという特殊なプログラム細胞死を起こすと,その直前に細胞質内でガレクチン10の分布が変化し,結晶化する.また,結晶は好酸球が死んだあと細胞外に出てきて粘液中などでも残存し続ける.Charcot-Leyden結晶の形成が好酸球,あるいはアレルギー疾患に対してどのような役割を果たしているのかは明らかになっていないが,近年,ガレクチン10が好中球,単球を炎症部位に呼び込む可能性があることが示唆されており,ガレクチン10に対する抗体を投与してCharcot-Leyden結晶を溶解すると炎症反応が抑制されるという興味深い実験結果も報告されている32).長年未知な点ばかりであったヒト体内における天然の細胞内結晶であったが,近年ようやく理解が進み始めたところである.
4)NEU1の細胞内結晶
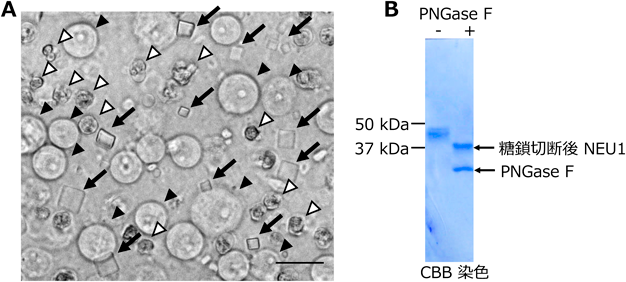
NEU1は上述のとおり粗面小胞体内腔で結晶を生じる.通常の接着細胞で結晶を生じさせると,一辺が数µm~30 µm程度,厚みが数µm程度の平板上あるいは直方体の形状で生じる.界面活性剤で細胞を溶解してもNEU1結晶は安定であることが著者らの研究で判明している(図4).取り出した結晶にX線自由電子レーザーを照射すると回折像が得られており,凝集体ではなく結晶であることが示されている34).ただし,結晶中のNEU1分子の向きが完全にそろっていない,すなわちモザイシティの高い結晶であり,単位格子中の分子数が多すぎるために結晶構造解析には至っていない14).これは,結晶を電子顕微鏡で観察すると,電子線が結晶に回折されることで通常みられる干渉縞があまり観察されないことからも結晶の質がよくないことが示されている.
一方,著者らは過去の研究で,細胞からNEU1結晶を抽出し,さらにその結晶からNEU1タンパク質だけを取り出す手法を開発している.その実験結果によると,CTSAやGLB1などは結晶に含まれておらず,純粋なNEU1分子の結晶であることが判明している.また,結晶から得られたNEU1に組換えCTSAを加えるとシアル酸型糖鎖の分解活性を示すことから,結晶に取り込まれているNEU1は活性のある構造を保っている.得られたNEU1をpeptide-N-glycosidase F(PNGase F)処理し,糖鎖を切断してSDS-PAGEにより解析すると低分子側にシフトすることから結晶中のNEU1にはN型糖鎖が付加されていた(図5).一般的にタンパク質分子表面に付加される糖鎖はタンパク質分子の可溶性を向上させて自己会合を防ぐ上,糖鎖自身もふらついていることから結晶化の阻害因子として働く.しかしながら,そのように複数本の糖鎖がついているにもかかわらずNEU1が簡単に結晶化することは特筆に値する.そこで,結晶化を促進する目的で,著者らがNEU1にN型糖鎖が付加しないようアミノ酸置換体を発現させる実験を行ったところ,予想に反して結晶化が起こりにくくなっていた15).これは,糖鎖が減ったことによりNEU1が立体構造をうまくとれなくなったためであると考えられる.また,通常のNEU1の細胞内結晶化が起こる場所を詳細に検討したところ,小胞体内腔だけでなくゴルジ体内腔でも結晶化していることを示唆するデータが得られている.具体的には,ゴルジ体局在タンパク質であるシアル酸トランスフェラーゼと緑色蛍光タンパク質との融合タンパク質であるST3GAL4-mEGFPとも共局在すること,結晶から単離したNEU1分子にはゴルジ体内腔で付加される末端シアル酸型糖鎖が付加されていること,一部の結晶がシアル酸認識レクチンで染色されることなどがその根拠となっている.なお,CTSAをNEU1と同時に過剰発現させると細胞内結晶化を抑制するが,完全に結晶化を抑えることはできない.このように,発見から10年以上が経つNEU1結晶であるが,現在においても未知の点が多いのが現状である.
1)NEU1欠損症
NEU1遺伝子変異による疾患をシアリドーシス35),CTSA遺伝子変異により引き起こされる疾患をガラクトシアリドーシス36)と呼ぶ.どちらもNEU1活性の著しい低下とそれに伴う基質蓄積が発症の原因である.シアル酸残基は糖鎖の非還元末端に主に結合しており,このシアル酸がNEU1によって分解されないとそこから先の糖の分解が起こらず,結果として糖鎖が蓄積する.NEU1欠損症はリソソーム病に分類され,厚生労働省により難病指定されている.両疾患とも精神発達遅延,中枢神経障害,視力低下,骨変形,肝脾腫など,ほとんど同じ臨床症状を示す.また,マウスCTSAのペプチダーゼ活性中心である190番目のセリンをアラニンに置換し,NEU1活性化能を残しながらペプチダーゼ活性を消失した変異CTSAを発現するノックインマウスでは,体内生理活性ペプチドの増加が報告されている37).一方で,このCtsa変異ノックインマウスではシアリドーシス様の神経障害,骨変形などの症状がみられない.そのため,ガラクトシアリドーシスの重篤な症状は主にNEU1活性の低下により引き起こされると考えられる.NEU1欠損症には重症度によっていくつかの病型があり,重症型のシアリドーシス,あるいはガラクトシアリドーシスの場合は乳幼児期に死亡する場合がある35).軽症型のシアリドーシス,ガラクトシアリドーシスの場合でも成人で著しく症状が悪化し,死亡する場合がある.また,シアリドーシス,ガラクトシアリドーシスは現在までに病因に直接作用するような根本的治療法は確立されておらず,抗てんかん薬を用いた対症療法を行うにとどまっている.
2)リソソーム病の治療法
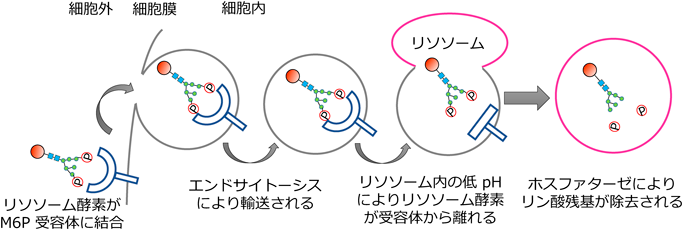
一般的にリソソーム病の治療法としてM6P型糖鎖と細胞表面の受容体を介した取り込み機構を利用する酵素補充療法が行われている(図5).一般的に,リソソーム酵素にはM6P型糖鎖が付加されるが,チャイニーズハムスター卵巣細胞などタンパク質製造に用いられる細胞に過剰発現させるとゴルジ体内腔に存在するM6P受容体が過剰発現させたリソソーム酵素で飽和し,M6P受容体に結合しきれないリソソーム酵素が分泌経路で輸送され,培地中に分泌される.分泌された酵素を回収・精製して製剤とする.しかしNEU1はGNPTに認識されないためM6P型糖鎖が付加されず,M6Pシステムを利用した酵素補充が困難である.CTSAはM6P型糖鎖を持つため酵素補充が可能であるが,細胞内での半減期が18時間程度と短く38),実用化されていない.また,一般に酵素タンパク質は血液脳関門を通過できないため,リソソーム酵素を末梢から静脈内などに投与しても中枢神経症状は緩和されない.そこで,頭蓋骨を貫通する装置を外科的に装着し,脳室内に直接酵素製剤を送り込む脳室内投与が近年開発されている.日本においても,2020年に脳室内投与製剤であるセルリポナーゼアルファ(神経セロイドリポフスチン症2型治療薬)や,2021年にイデュルスルファーゼベータ(ムコ多糖症II型治療薬)が販売されている.他にも,血液脳関門を透過する抗体とリソソーム酵素の融合タンパク質を末梢から投与し,中枢神経に移行させる新しい酵素製剤であるパビナフスプアルファ(ムコ多糖症II型治療薬)が販売され始めている.
リソソーム病に対する治療法として現在は酵素補充が主流であるが,近年発展が目覚ましい遺伝子治療の臨床試験も複数行われており,有効性や安全性が検証されつつある.
3)NEU1欠損症治療の展望
ガラクトシアリドーシスについては,CTSAにM6P型糖鎖が付加されることから末梢への酵素補充39),遺伝子治療40)の基礎研究が過去に行われている.
シアリドーシスに関しては,NEU1にM6Pが付加されないことからシアリドーシスに対する酵素補充療法を志向した治療薬の開発がほとんど進んでいない.また遺伝子治療についても,NEU1を発現させすぎると細胞内結晶を生じ,細胞が物理的に損傷し,有害作用につながると考えられるため行われていない.一方,著者らの研究で細胞内結晶を生じない変異型NEU1の作製を試みており,実際にいくつかのアミノ酸置換体を発現させたところ,活性を持ちながら結晶化しないNEU1変異体の開発に成功している.具体的には,NEU1のアミノ酸配列を一部置換し,N-X-T or S(Xはプロリン以外のアミノ酸)という,N型糖鎖を付加するのに必要な配列を新たに増やしてN型糖鎖をより多く持つようにしている.糖鎖はタンパク質の親水性を上げ,分子間での会合を阻害するため結晶化が起こらなくなったと推察される.当該遺伝子とCTSAを同時発現するようにアデノ随伴ウイルスベクター(AAV)に搭載し,遺伝子治療研究への応用を目指して研究を行っている.CTSAと同時に発現するようにしておくことで,モデルマウスに対する遺伝子治療研究では顕著な有効性を示しており,今後実用化を目指して研究を進めていきたいところである.