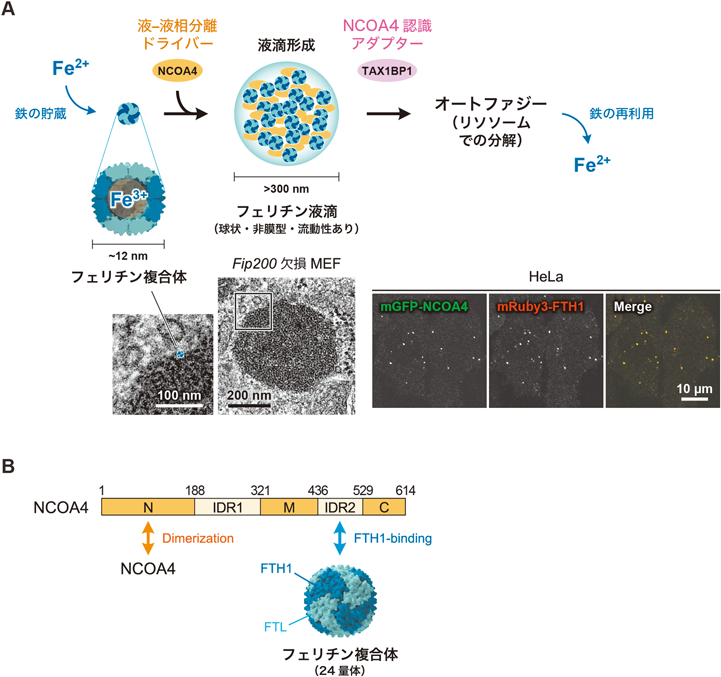
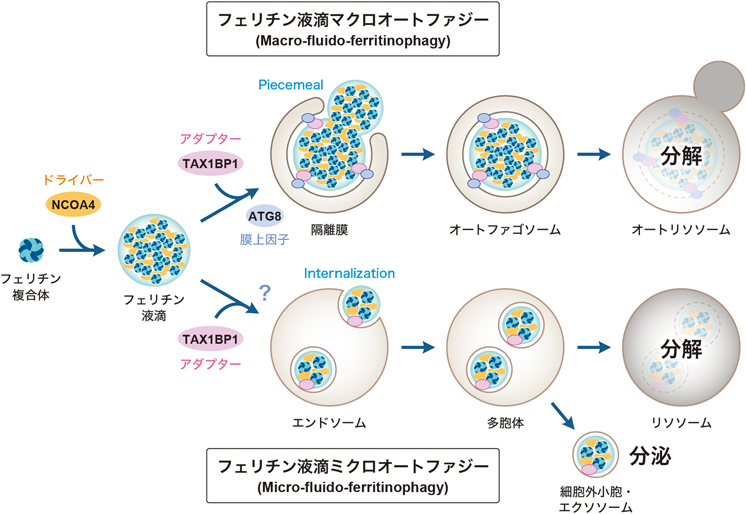
鉄貯蔵タンパク質フェリチンの液滴形成と二つのオートファジー経路での分解Ferritin condensates: Formation by liquid–liquid phase separation and degradation via two autophagy pathways
1 日本医科大学先端医学研究所遺伝子制御学分野Department of Molecular Oncology, Institute for Advanced Medical Sciences, Nippon Medical School ◇ 〒113–8602 東京都文京区千駄木1–1–5 ◇ 1–1–5 Sendagi, Bunkyo-ku, Tokyo 113–8602, Japan
2 東京大学大学院医学系研究科分子生物学分野Department of Biochemistry and Molecular Biology, Graduate School of Medicine, The University of Tokyo ◇ 〒113–0033 東京都文京区本郷7–3–1 ◇ 7–3–1 Hongo, Bunkyo-ku, Tokyo 113–0033, Japan