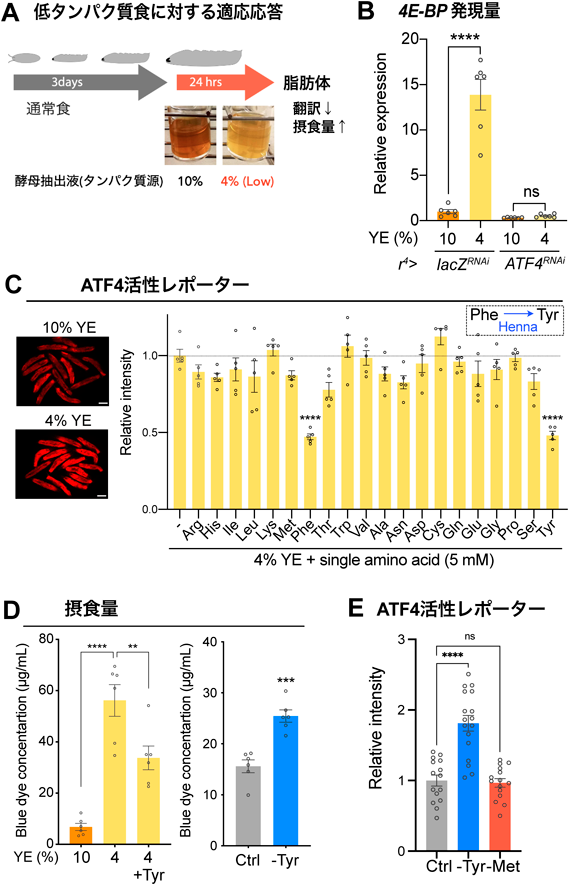
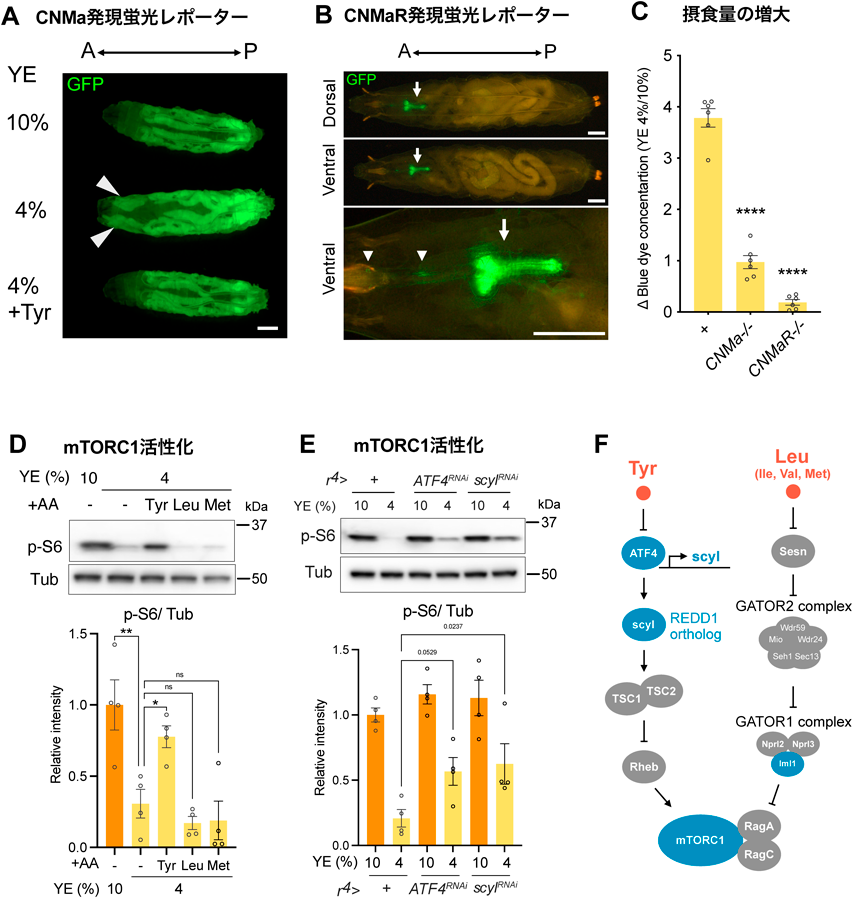
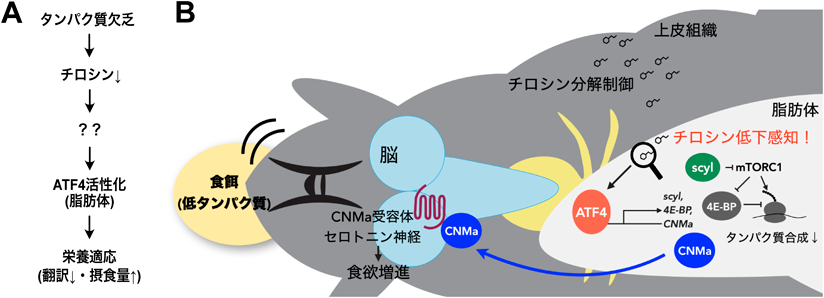
非必須アミノ酸チロシンの感知による栄養適応機構Adaptive nutritional response by sensing nonessential amino acid tyrosine
理化学研究所生命機能科学研究センターRIKEN Center for Biosystems Dynamics Research ◇ 〒650–0047 兵庫県神戸市中央区港島南町2丁目2–3 ◇ 2–2–3 Minatojima-minamimachi, Chuo-ku, Kobe, Hyogo 650–0047, Japan